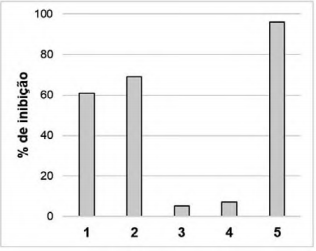
Muitos laboratórios armazenam em seus
estoques soluções concentradas de reagentes. Um
técnico responsável dispõe, em seu laboratório, de
uma solução de etanol (álcool absoluto) a 16,3 mol/L.
O volume de água, em litros, que deve ser adicionado
a 400 mL de solução de etanol a 16,3 mol/L (álcool
absoluto) para produzir etanol hidratado a 70 % v/v é,
aproximadamente:
(Dado: detanol = 0,8 g/mL)
Muitos laboratórios armazenam em seus estoques soluções concentradas de reagentes. Um técnico responsável dispõe, em seu laboratório, de uma solução de etanol (álcool absoluto) a 16,3 mol/L. O volume de água, em litros, que deve ser adicionado a 400 mL de solução de etanol a 16,3 mol/L (álcool absoluto) para produzir etanol hidratado a 70 % v/v é, aproximadamente:
(Dado: detanol = 0,8 g/mL)