A reação de decomposição do ozônio é
representada pela equação a seguir:
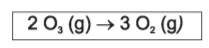
Num dado experimento de decomposição do ozônio,
observou-se a variação da concentração molar de O3 em função do tempo, demonstrada no quadro abaixo.

Analisando os dados experimentais, a velocidade
média de produção de gás oxigênio (O2), em
mol/L.minuto, nos 3 minutos iniciais da reação é:
A reação de decomposição do ozônio é representada pela equação a seguir:
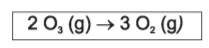
Num dado experimento de decomposição do ozônio, observou-se a variação da concentração molar de O3 em função do tempo, demonstrada no quadro abaixo.

Analisando os dados experimentais, a velocidade
média de produção de gás oxigênio (O2), em
mol/L.minuto, nos 3 minutos iniciais da reação é: