Questõesde CEDERJ sobre Química
O mercúrio é um metal prateado que, em
temperatura ambiente, é líquido e inodoro. Quando a
temperatura é aumentada, transforma-se em vapor
tóxico e corrosivo. Trata-se de produto perigoso à saúde
quando inalado, ingerido ou em contato, causando
irritação na pele, olhos e vias respiratórias. Uma forma
de obtenção de mercúrio se dá por ustulação do sulfeto
de mercúrio II (ou cinábrio) segundo a reação:
HgS + O2 → Hg + SO2
Sabendo-se que o sulfeto de mercúrio II possui 70 % de
pureza, a massa de mercúrio produzida pela ustulação
de uma tonelada do composto é
O mercúrio é um metal prateado que, em temperatura ambiente, é líquido e inodoro. Quando a temperatura é aumentada, transforma-se em vapor tóxico e corrosivo. Trata-se de produto perigoso à saúde quando inalado, ingerido ou em contato, causando irritação na pele, olhos e vias respiratórias. Uma forma de obtenção de mercúrio se dá por ustulação do sulfeto de mercúrio II (ou cinábrio) segundo a reação:
HgS + O2 → Hg + SO2
A cor natural do cabelo humano é definida,
basicamente, pela quantidade de melanina que cada ser
humano possui.Todos os dias, milhões de pessoas
recorrem a uma série de reações químicas para mudar a
cor dos fios. Essas reações envolvem, pelo menos, três
substâncias: peróxido de hidrogênio (H2
O2
), amônia (NH3
)
e acetato de chumbo (Pb(C2
H3
O2
)
2 ), que variam conforme
o produto.
Considerando a informação dada, os tipos de ligações
existentes entre as substâncias citadas são,
respectivamente:
O hélio é um gás monoatômico, incolor e inodoro,
que apresenta o menor ponto de evaporação de todos os
elementos químicos, e só pode ser solidificado sob
pressão elevada. Embora seja o segundo elemento
químico em abundância no universo, encontram-se, na
atmosfera terrestre, apenas traços provenientes da
desintegração de alguns de seus elementos. Em alguns
depósitos naturais de gás, é encontrado em quantidade
suficiente para a sua exploração. Estima-se que uma
reserva encontrada na Tanzânia contenha mais de 15
bilhões de metros cúbicos desse gás.
Considerando a densidade He = 0.18 kg/m³ , indique o número de átomos do gás hélio existente na reserva.
O hélio é um gás monoatômico, incolor e inodoro,
que apresenta o menor ponto de evaporação de todos os
elementos químicos, e só pode ser solidificado sob
pressão elevada. Embora seja o segundo elemento
químico em abundância no universo, encontram-se, na
atmosfera terrestre, apenas traços provenientes da
desintegração de alguns de seus elementos. Em alguns
depósitos naturais de gás, é encontrado em quantidade
suficiente para a sua exploração. Estima-se que uma
reserva encontrada na Tanzânia contenha mais de 15
bilhões de metros cúbicos desse gás.
Considerando a densidade He = 0.18 kg/m³ , indique o número de átomos do gás hélio existente na reserva.
O fentanil é um fármaco do grupo dos opioides,
sendo um potente analgésico narcótico usado no
tratamento da dor. Esse fármaco foi sintetizado a partir
de compostos análogos ao opioide e tem sido usado, de
forma inadequada, como droga recreacional e, portanto,
causador de numerosas fatalidades. Sua fórmula estrutural
é apresentada a seguir:
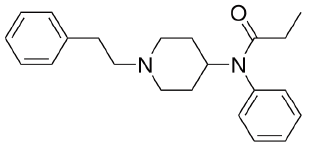
Tal fármaco possui

A reação de combustão de um dos componentes
do gás de cozinha, o gás butano, pode ser representada
pela seguinte equação química não balanceada:
C4
H10(g) + O2(g) → CO2(g) + H2
O(l). Considerando que o
volume molar de um gás ideal, nas CNTP é 22.4 L/mol, é
correto afirmar:
Considerando os conceitos de mol e do valor da
constante de Avogadro, é correto afirmar:
Titularam-se 20.00 mL de uma solução de HCl
0.1000 M com uma solução de NaOH 0.1000 M.
O valor de pH quando o volume titulante adicionado for
1.00% maior do que o volume necessário para que o ponto
de equivalência seja alcançado é
Uma amostra de CaCl2
impura foi dissolvida e
titulada com solução de AgNO3
:
CaCl2
+ 2AgNO3 → Ca(NO3
)2
+ 2AgCl
Determinou-se que 46.35 mL de uma solução de
AgNO3
0.1034 M titulam uma amostra de CaCl2
de massa
0.2843 g.
O percentual de CaCl2
na amostra é
Uma amostra de CaCl2 impura foi dissolvida e titulada com solução de AgNO3 :
CaCl2 + 2AgNO3 → Ca(NO3 )2 + 2AgCl
Determinou-se que 46.35 mL de uma solução de AgNO3 0.1034 M titulam uma amostra de CaCl2 de massa 0.2843 g.
O percentual de CaCl2
na amostra é
93.3 %
Existem quatro números quânticos: número
quântico principal; número quântico de momento angular
ou azimutal (secundário); número quântico magnético e
número quântico de spin. Esses quatro números
quânticos, além de se complementarem, nos permitem
fazer uma descrição completa dos elétrons nos átomos,
pois eles representam o nível principal de energia do
elétron, o subnível de energia, a orientação espacial da
nuvem eletrônica e a orientação do próprio elétron na
nuvem.
Considerando as informações, dentre as seguintes séries
de números quânticos abaixo, aquela que descreve
corretamente um elétron em um dado átomo é:
Existem quatro números quânticos: número quântico principal; número quântico de momento angular ou azimutal (secundário); número quântico magnético e número quântico de spin. Esses quatro números quânticos, além de se complementarem, nos permitem fazer uma descrição completa dos elétrons nos átomos, pois eles representam o nível principal de energia do elétron, o subnível de energia, a orientação espacial da nuvem eletrônica e a orientação do próprio elétron na nuvem.
Considerando as informações, dentre as seguintes séries de números quânticos abaixo, aquela que descreve corretamente um elétron em um dado átomo é:
Para evitar bolor em armários, utilizam-se produtos
denominados “sais secantes", como o CaCl2
anidro, que
é higroscópico, isto é, capaz de absorver moléculas de
água. Por essa razão, o frasco contendo este secante
acaba por acumular líquido no fundo, que nada mais é do
que solução aquosa de cloreto de cálcio. Com base nessa
informação e utilizando – caso necessário – a tabela
periódica, analise as afirmativas a seguir:
I O cloreto de cálcio é um sólido iônico.
II O cloreto de cálcio sólido é um bom condutor de
eletricidade.
III Para ser usado como “secante de armário", o sal
deve ser higroscópico.
São verdadeiras:
I O cloreto de cálcio é um sólido iônico.
II O cloreto de cálcio sólido é um bom condutor de eletricidade.
III Para ser usado como “secante de armário", o sal deve ser higroscópico.
São verdadeiras:
O efeito íon comum decorre da diminuição da
solubilidade de um sal ao se agregar um dos íons. O
aumento da concentração de um dos íons que formam o
precipitado deve corresponder à diminuição da do outro,
para que o Kps permaneça constante, a uma temperatura
determinada. Esse efeito é o que permite reduzir a
solubilidade de muitos precipitados ou precipitar,
quantitativamente, um íon, usando excesso de agente
precipitante. O valor do Kps do hidróxido de magnésio é
8.9 x 10-12, a 25.0°C.
A solubilidade desse composto a 25.0°C, em água pura
e em uma solução de pH igual a 13.00, será,
respectivamente, em molL-1 :
A solubilidade desse composto a 25.0°C, em água pura e em uma solução de pH igual a 13.00, será, respectivamente, em molL-1 :
Segundo a teoria eletrolítica de Arrhenius, que
considera o comportamento das substâncias quando
dissolvidas em água, a função inorgânica dos sais pode
ser definida da seguinte forma: Sal é toda substância
que, em solução aquosa, sofre dissociação, liberando
pelo menos um cátion diferente do H+
ou H3O+
e um aníon
diferente do OH- .
O sal formado entre o ácido bórico e o hidróxido de
magnésio apresenta a seguinte composição centesimal:
O sal formado entre o ácido bórico e o hidróxido de magnésio apresenta a seguinte composição centesimal:
Considere as condições de remoção de Cl2
, adição
de PCl3
e diminuição do volume do recipiente que estão
relacionadas com a reação
PCl3(g) + Cl2(g) PCl5(g)
Sob essas condições, o efeito causado sobre a referida
reação é:
Define-se por eletrólise o processo no qual se induz
no sistema, artificial e forçadamente, uma corrente – seja
ela elétrica ou química – a fim de se obter uma reação
química, convertendo energia elétrica em energia química
ou vice-versa. Em resumo, quando dois compostos
entram em contato químico, seus elementos são
separados, de modo forçado, através da corrente elétrica
de energia química.
Em relação à eletrólise,
Em relação à eletrólise,