Existem quatro números quânticos: número
quântico principal; número quântico de momento angular
ou azimutal (secundário); número quântico magnético e
número quântico de spin. Esses quatro números
quânticos, além de se complementarem, nos permitem
fazer uma descrição completa dos elétrons nos átomos,
pois eles representam o nível principal de energia do
elétron, o subnível de energia, a orientação espacial da
nuvem eletrônica e a orientação do próprio elétron na
nuvem.
Considerando as informações, dentre as seguintes séries
de números quânticos abaixo, aquela que descreve
corretamente um elétron em um dado átomo é:
Existem quatro números quânticos: número quântico principal; número quântico de momento angular ou azimutal (secundário); número quântico magnético e número quântico de spin. Esses quatro números quânticos, além de se complementarem, nos permitem fazer uma descrição completa dos elétrons nos átomos, pois eles representam o nível principal de energia do elétron, o subnível de energia, a orientação espacial da nuvem eletrônica e a orientação do próprio elétron na nuvem.
Considerando as informações, dentre as seguintes séries de números quânticos abaixo, aquela que descreve corretamente um elétron em um dado átomo é:
Gabarito comentado
Como descrito no enunciado, existem quatro números quânticos que podem descrever os elétrons nos átomos:
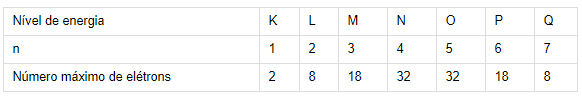
● número quântico principal (n) - especifica o nível de energia ou “camada" que o elétron ocupa:
Com base no exposto, observemos a análise das alternativas:
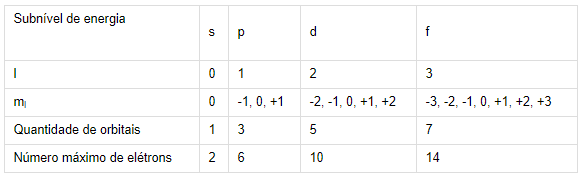
A) ERRADA – n = 4, l = 4, ml = 3, ms = + ½
Não existe l = 4, ele só assume valores até 3, como mostrado na segunda tabela acima, pois só existem 4 subníveis de energia (s, p, d e f) e o valor de l começa no 0.
Dessa forma, essa não é uma descrição correta para um elétron de determinado átomo.
B) ERRADA – n = 3, l = 2, ml = - 3, ms = - ½
C) ERRADA – n = 0, l = 0, ml = 0, ms = + ½
D) CORRETA – n = 3, l = 1, ml = 0, ms = - ½






