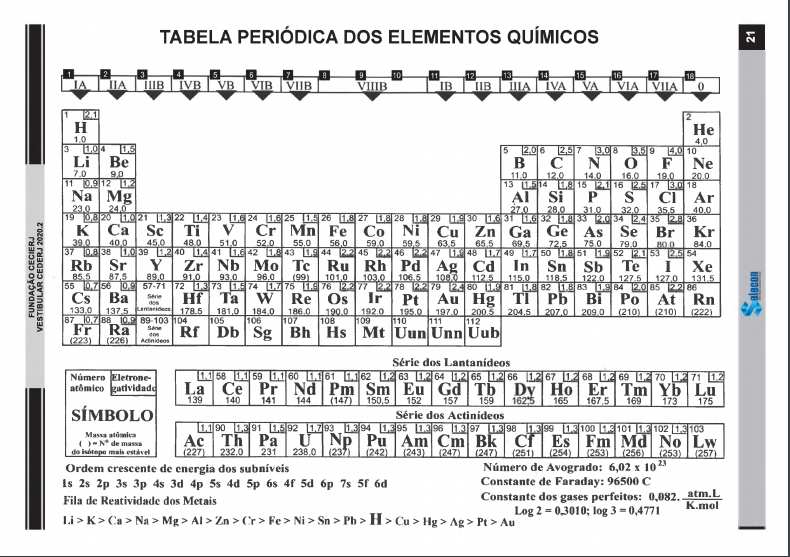
Uma amostra de uma rocha de massa
0.250 g, com baixo teor de Cr, foi submetida à
fusão com Na2O2 transformando o cromo em
cromato (CrO4
=
). A amostra foi dissolvida em
água em ebulição, acidificada e o CrO4
=
foi
convertido a dicromato (Cr2O7
=
). Na sequência,
a amostra foi titulada com 27 mL de solução de
Fe2+. Os produtos desta reação foram Fe3+ e
Cr3+. Numa padronização paralela, 47 mL de
Fe2+ foram usados na redução de 0.1172 g de
K2Cr2O7. A reação decorrente foi:
Cr2O7
= + 6Fe2+ + 14H+ → 2Cr3+ + 6Fe3+ + 7H2O.
A massa percentual de Cr na amostra é:
Uma amostra de uma rocha de massa 0.250 g, com baixo teor de Cr, foi submetida à fusão com Na2O2 transformando o cromo em cromato (CrO4 = ). A amostra foi dissolvida em água em ebulição, acidificada e o CrO4 = foi convertido a dicromato (Cr2O7 = ). Na sequência, a amostra foi titulada com 27 mL de solução de Fe2+. Os produtos desta reação foram Fe3+ e Cr3+. Numa padronização paralela, 47 mL de Fe2+ foram usados na redução de 0.1172 g de K2Cr2O7. A reação decorrente foi:
Cr2O7 = + 6Fe2+ + 14H+ → 2Cr3+ + 6Fe3+ + 7H2O.
A massa percentual de Cr na amostra é: