Questõessobre Sistemas Homogêneos: Equilíbrio Químico na Água: pH e pOH, Indicadores Ácido-Base, Solução Tampão.
O pH (potencial hidrogeniônico)
é uma medida que verifica se a água está ácida
(pH baixo), neutra (pH 7,0) ou alcalina (pH alto).
Sua escala varia de 0,0 a 14,0. Em piscinas, o pH
deve ser mantido entre 7,2 e 7,6. Normalmente
quando a água está esverdeada, em quase 90%
dos casos é porque pH esta muito baixo. Um
técnico determinou que a concentração
hidrogeniônica de uma piscina era igual a 4,0
x10-8 mol/L. Assim, pode-se inferir que (Dados:
log 4,0 = 0,6):
Uma garrafa de vinho depois de aberta teve seu conteúdo analisado, apresentando uma concentração de íons
H3O+
igual a 3,2 x 10-4mol L-1. Após ser consumida a metade do vinho, o restante foi armazenado durante
certo tempo em contato com o ar e outra análise detectou uma concentração de H3O+
igual a
1,0 X 10-3 mol L-1. Nessas duas situações, pode-se afirmar:
No processo de tratamento de água para abastecimento público, é comum utilizar sulfato de alumínio para
provocar a coagulação/floculação dos materiais finos em suspensão. Ao ser adicionado à água o sulfato de
alumínio produz íons Al3+ e SO42-. Os íons Al3+ reagem com a água produzindo hidróxido de alumínio Al(OH)3 ,
que é o responsável pela coagulação/floculação. Esta reação está representada de modo simplificado abaixo:
Al2(SO4)3 + 6H2O → 2Al(OH)3 + 6 H+
+ 3SO42-
O excesso de íons H+
formado tende a diminuir o pH do meio, o que pode contribuir para a interrupção
da formação do Al(OH)3, atrapalhando o processo de coagulação/floculação. Em alguns casos, o excesso de H+
é removido pela alcalinidade presente nas águas naturais. Se a alcalinidade do meio não for suficiente, o pH
deve ser aumentado pela adição de outras substâncias. Disponível em: <http://qnesc.sbq.org.br/online/cadernos/01/aguas.pdf> Acesso em: 1 nov. 2011 (adaptado).
É possível aumentar o pH do meio aquoso adicionando-se a seguinte substância:
A concentração do íon hidroxônio, [H3O+], da água é 1,0 x 10-6 mol L-1 a 100ºC. Valor, aproximadamente,
dez vezes a concentração do mesmo íon da água a 25ºC. Sobre o exposto, é CORRETO afirmar que:
Foram preparadas misturas de acordo com a descrição a seguir:
I: 100 mL de H2O e 4,9 g de H2SO4
II: 100 mL de H2O e 4,48 g de KOH
III: 100 mL de H2O e 0,5 g de AgOH
Dado: KpS AgOH = 10-8
Todas as afirmativas são verdadeiras, EXCETO:
Foram preparadas misturas de acordo com a descrição a seguir:
I: 100 mL de H2O e 4,9 g de H2SO4
II: 100 mL de H2O e 4,48 g de KOH
III: 100 mL de H2O e 0,5 g de AgOH
Dado: KpS AgOH = 10-8
Todas as afirmativas são verdadeiras, EXCETO:
O rótulo de uma garrafa de água mineral trazia as
seguintes informações ao consumidor:
Características físico-químicas:
pH na fonte: 9,00
Temperatura da Água na Fonte: 25,0°C
Condutividade a 25° C: 531µS/cm
Resíduo de Evaporação a 180° C,
calculado: 320,0 mg/L.
Com base nessas informações, analise os itens a
seguir:
I) Considerando kw sendo 10–14, a concentração de
íons OH–
dessa água mineral, na fonte, é 10–5 mol/L.
II) Essa água mineral tem elevada acidez.
III) Caso 200 mL de água sejam evaporados, espera-se em torno de 64 mg de resíduo de evaporação.
Está(ão) correto(s) apenas:
O rótulo de uma garrafa de água mineral trazia as seguintes informações ao consumidor:
Características físico-químicas:
pH na fonte: 9,00
Temperatura da Água na Fonte: 25,0°C
Condutividade a 25° C: 531µS/cm
Resíduo de Evaporação a 180° C,
calculado: 320,0 mg/L.
Com base nessas informações, analise os itens a seguir:
I) Considerando kw sendo 10–14, a concentração de íons OH– dessa água mineral, na fonte, é 10–5 mol/L.
II) Essa água mineral tem elevada acidez.
III) Caso 200 mL de água sejam evaporados, espera-se em torno de 64 mg de resíduo de evaporação.
Está(ão) correto(s) apenas:
Peixes de aquário dependem do pH da água para sobreviver. Alguns precisam de pH alcalino, outros
vivem bem no pH neutro, alguns precisam de pH ácido e outros conseguem viver em dois ou mais
desses ambientes. Antes de colocar os peixes no aquário, é preciso colocar o pH na acidez ideal para
que eles sobrevivam. O quadro a seguir mostra 5 (cinco) espécies de peixes e os valores das faixas de
pH indicado para sua sobrevivência no aquário:
Espécie Nome científico do peixe pH
I Symphysodon discus 4,5 < pH < 6,5
II Danio aequipinnulus 7,0
III Hemichromis bimaculatus 7,0 < pH < 7,5
IV Poecilia latipinna 7,8
V Astronotus ocellatus 6,5 < pH < 8,0
As figuras a seguir mostram os valores das concentrações hidroxiliônicas [OH-] a 25°C nas águas dos
aquários A, B e C, respectivamente:
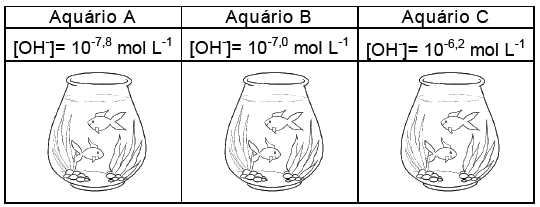
A partir desses dados, é CORRETO concluir que em função do pH da água dos aquários:

HOOCCH2C(OH)CH2COOH
│
COOH
Ácido Cítrico
O ácido cítrico, responsável pela acidez das frutas cítricas, é
utilizado como acidificante e flavorizante no processamento de
alguns alimentos.
A partir dessas informações, é correto afirmar:
A solução aquosa, 1,0.10−2 mol.L−1 , de ácido cítrico completamente ionizada apresenta pH = 2,0.
Ácido Halogenídrico Constante de ionização, Ka, a 25º C
HF (aq) 6,0.10-4
HC (aq) 1,0.107
HBr (aq) 1,0.109
HI (aq) 3,0.109
A tabela relaciona os valores da constante de ionização, Ka,
dos ácidos halogenídricos.
A partir da análise dessa tabela, é correto afirmar:
Ácido Halogenídrico Constante de ionização, Ka, a 25º C
HF (aq) 6,0.10-4
HC (aq) 1,0.107
HBr (aq) 1,0.109
HI (aq) 3,0.109
A tabela relaciona os valores da constante de ionização, Ka, dos ácidos halogenídricos.
A partir da análise dessa tabela, é correto afirmar:
I. CaC2(s) + N2(g) 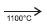 CaNCN(s) + C(s)
CaNCN(s) + C(s)
II. CaNCN(s) + 5H2O(ℓ) → CaCO3(s) + 2NH4OH(aq)
Quando carbeto de cálcio, CaC2, é aquecido em um forno
elétrico, na presença de nitrogênio atmosférico, a 1100ºC, dá
origem à cianamida de cálcio, empregada largamente como
fertilizante nitrogenado de ação lenta, pois leva alguns meses,
no solo, para se hidrolisar de acordo com a equação
química II. Como a cianamida de cálcio não é arrastada pelas
chuvas, é um fertilizante melhor do que o nitrato de amônio,
NH4NO3, e a ureia, CO(NH2)2.
Uma análise dessas informações permite afirmar:
I. CaC2(s) + N2(g) 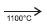 CaNCN(s) + C(s)
CaNCN(s) + C(s)
II. CaNCN(s) + 5H2O(ℓ) → CaCO3(s) + 2NH4OH(aq)
Quando carbeto de cálcio, CaC2, é aquecido em um forno elétrico, na presença de nitrogênio atmosférico, a 1100ºC, dá origem à cianamida de cálcio, empregada largamente como fertilizante nitrogenado de ação lenta, pois leva alguns meses, no solo, para se hidrolisar de acordo com a equação química II. Como a cianamida de cálcio não é arrastada pelas chuvas, é um fertilizante melhor do que o nitrato de amônio, NH4NO3, e a ureia, CO(NH2)2.
Uma análise dessas informações permite afirmar:
Fe3+(aq) + 3H2O(ℓ) Fe(OH)3(s) + 3H+(aq)
A presença de íons Fe3+(aq) é responsável pelas propriedades
características de água ferruginosa de alguns rios.
Uma análise da presença de íons Fe3+(aq) nas águas
ferruginosas de alguns rios permite concluir:
A concentração hidrogeniônica de água que contém Fe3+(aq) é menor que 1,0.10−7 .
HBrO(ℓ) + H2O(ℓ) ⇌ H+(aq) + BrO−(aq) Ka = 2,1.10−9
Os trabalhos do químico alemão Friedrich Willhelm Ostwald
sobre a relação matemática entre constante de ionização,
Ka, com o grau de ionização, α, e com a concentração
em mol.L−1
, m, de um ácido fraco ficaram conhecidos
como a Lei de diluição de Ostwald, representada pela
expressão Ka= a2 .m/ 1 - α. As suas pesquisas levaram-no ao
recebimento, em 1909, do prêmio Nobel de Química.
A partir dessas informações e da reação de ionização do ácido
hipobromoso, em uma solução 0,1 molar desse ácido,
representada pela equação química, é correto afirmar:
A fenolftaleína atua como um indicador ácido-base por
ser um ácido fraco, que em solução alcóolica, apresenta a
cor das moléculas não-dissociadas, HInd, diferente da cor
dos respectivos íons, Ind–.
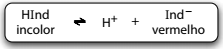
A leitura da mensagem no experimento descrito é possível
porque a presença de íons OH– na solução de fenolftaleína
promove deslocamento do equilíbrio para a
A fenolftaleína atua como um indicador ácido-base por ser um ácido fraco, que em solução alcóolica, apresenta a cor das moléculas não-dissociadas, HInd, diferente da cor dos respectivos íons, Ind–.

A leitura da mensagem no experimento descrito é possível
porque a presença de íons OH– na solução de fenolftaleína
promove deslocamento do equilíbrio para a
Experiência – Escrever uma mensagem secreta no laboratório
Materiais e Reagentes Necessários
✓ Folha de papel
✓ Pincel fino
✓ Difusor
✓ Solução de fenolftaleína
✓ Solução de hidróxido de sódio 0,1 mol/L ou solução saturada de hidróxido de cálcio
Procedimento Experimental
Utilizando uma solução incolor de fenolftaleína, escreva com um pincel fino uma mensagem numa folha de papel.
A mensagem permanecerá invisível.
Para revelar essa mensagem, borrife a folha de papel com uma solução de hidróxido de sódio ou de cálcio, com o auxílio de um difusor.
A mensagem aparecerá magicamente com a cor vermelha.
Explicação
fenolftaleína é um indicador que fica vermelho na presença de soluções básicas, nesse caso, uma solução de hidróxido de sódio ou de cálcio.
Na indústria têxtil, é uma prática comum aplicar goma aos tecidos no início da produção, para torná-los mais resistentes.
Esse produto, entretanto, precisa ser removido posteriormente, no processo de desengomagem. Nesse processo, os
produtos têxteis são mergulhados em um banho aquoso com uma enzima do grupo das amilases.
Os gráficos nas figuras 1 e 2 representam a eficiência da atividade dessa enzima em diferentes valores de temperatura
e pH.

Com base nas informações apresentadas, está correto afirmar que, para se obter a máxima eficiência da ação da enzima no
processo industrial citado no texto, seria necessário manter o banho aquoso de desengomagem a
Na indústria têxtil, é uma prática comum aplicar goma aos tecidos no início da produção, para torná-los mais resistentes. Esse produto, entretanto, precisa ser removido posteriormente, no processo de desengomagem. Nesse processo, os produtos têxteis são mergulhados em um banho aquoso com uma enzima do grupo das amilases.
Os gráficos nas figuras 1 e 2 representam a eficiência da atividade dessa enzima em diferentes valores de temperatura e pH.

Com base nas informações apresentadas, está correto afirmar que, para se obter a máxima eficiência da ação da enzima no
processo industrial citado no texto, seria necessário manter o banho aquoso de desengomagem a
A força dos ácidos pode ser considerada como um parâmetro que mede a quantidade de íons H+ liberados para solução quando diluídos em água.
Sobre a força dos ácidos, o grau de ionização e o cálculo do pH, relacione a coluna da esquerda com a da
direita.
(I) CH3COOH (Ka = 1,80×10−5
)(II) HCℓ (Ka = 1,00×107)(III) HF (Ka = 6,70×10−4)(IV) HCN (Ka = 4,90×10−10)(V) HNO2 (Ka = 6,09×10−6)
(A) Possui o menor grau de ionização. (B) É o ácido mais forte.(C) Se a concentração do ácido for 1,50 mol/L, o pH da solução
será, aproxidamente, de 2,50. (D) Se a concentração do ácido for 1,50 mol/L, o pH da solução
será, aproxidamente, de 2,30. (E) Se o ácido está 2% ionizado, a sua concentração é, aproximadamente, de 1,70 mol/L.
Assinale a alternativa que contém a associação correta.
A força dos ácidos pode ser considerada como um parâmetro que mede a quantidade de íons H+ liberados para solução quando diluídos em água.
Sobre a força dos ácidos, o grau de ionização e o cálculo do pH, relacione a coluna da esquerda com a da direita.
A escala de pH que varia de 0 a 14 é válida apenas para
sistemas aquosos a 25 °C. Variando-se a temperatura, a
escala de pH também varia.
O quadro fornece valores de Kw e de pH da água pura em
diferentes temperaturas
Temperatura (°C) Kw pH 0 1,14 × 10–15 7,47 10 2,95 × 10–15 7,27 20 1,00 × 10–14 7,00 30 1,47 × 10–14 6,83 50 5,30 × 10–14 6,27
Analisando-se os dados, pode-se afirmar, corretamente,
que a
O leite de vaca possui um pH levemente ácido de 6,6. Em caso de mastite, inflamação da glândula mamária
causada por bactérias, o pH torna-se alcalino. Portanto, qual deve ser o valor do pH do leite de um animal
com mastite?
 Kb = 2,0x10-12
Kb = 2,0x10-12
O indol tem odor semelhante à essência floral, quando
bastante diluído em etanol, e odor muito forte, quando em
solução etanólica concentrada.
Considerando-se essas informações, é correto afirmar que o
indol
 Kb = 2,0x10-12
Kb = 2,0x10-12tem ácido conjugado formado a partir da reação
com a água, representado pela fórmula 
Para explorar convenientemente a cultura da soja, é indispensável incorporar calcário aos solos
que estão com pH inferior a 5,5. A quantidade de calcário a ser aplicada no terreno é determinada
através da análise do solo.
Considerando-se essas informações, é INCORRETO afirmar que
Para explorar convenientemente a cultura da soja, é indispensável incorporar calcário aos solos que estão com pH inferior a 5,5. A quantidade de calcário a ser aplicada no terreno é determinada através da análise do solo.
Considerando-se essas informações, é INCORRETO afirmar que