Questõessobre Representação das transformações químicas
O
alumínio é obtido pela eletrólise da bauxita. Nessa eletrólise, ocorre a
formação de oxigênio que reage com um dos eletrodos de carbono utilizados no
processo. A equação não balanceada que representa o processo global é:
Al2O3 + C 
 CO2 + Al
CO2 + Al
Para 2
mols de Al2O3, quantos mols de CO2 e Al, respectivamente, são produzidos nesse
processo?
O
alumínio é obtido pela eletrólise da bauxita. Nessa eletrólise, ocorre a
formação de oxigênio que reage com um dos eletrodos de carbono utilizados no
processo. A equação não balanceada que representa o processo global é:
 CO2 + Al
CO2 + Al Para 2
mols de Al2O3, quantos mols de CO2 e Al, respectivamente, são produzidos nesse
processo?
Observe a equação
química:
CHCl3(g) + Cl2(g)  CCl4(g) + HCl(g)
CCl4(g) + HCl(g)
Considerando reagir 11,9 g de CHCl3 em
um ambiente contendo gás cloro em excesso, qual a massa aproximada, em gramas, de HCl(g) produzida se a reação
apresentar 75 % de rendimento?
 CCl4(g) + HCl(g)
CCl4(g) + HCl(g)
Uma das reações químicas envolvidas no refino do minério de Ferro é a do Óxido Ferroso com Monóxido de Carbono, que gera Ferro reduzido e Dióxido de Carbono, mostrada a seguir:
FeO + CO  Fe + CO2
Fe + CO2
Massas Molares:
ü FeO: 71,8 g.mol-1
ü CO: 28 g.mol-1
ü Fe: 55,8 g.mol-1
ü CO2: 44 g.mol-1
A massa de dióxido de carbono produzida para a obtenção de 111,6 g de Ferro reduzido é:
 Fe + CO2
Fe + CO2
O medicamento denominado genericamente de paracetamol é indicado, em
adultos, para a redução da febre e para o alívio temporário de dores leves a
moderadas. Pode ser administrado ao paciente na dosagem máxima de 75 mg/kg
de massa corpórea. Considerando-se que um paciente tenha 70 kg, e que cada
comprimido de paracetamol contenha 750 mg desse princípio ativo, o número
de comprimidos inteiros, que pode ser tomado para que a dosagem máxima seja
alcançada, é de
Dada a equação química
não balanceada:
Na2CO3 + HCℓ  NaCl + CO2 + H2O
NaCl + CO2 + H2O
A massa, em gramas, de carbonato de
sódio que reage completamente com 0,25
mols de ácido clorídrico é:
 NaCl + CO2 + H2O
NaCl + CO2 + H2O
A massa, em gramas, de carbonato de sódio que reage completamente com 0,25 mols de ácido clorídrico é:
Observe os dados abaixo,
considerados a 25º C e 1 atm:
ΔH de formação do CO2 = - 94,1 kcal
ΔH de formação do H2O = - 68,3 kcal
ΔH de formação do etanol (C2H6O) = - 66,1
kcal.
A quantidade de calor (em kcal)
desprendida na reação de combustão
completa de 0,5 mol de etanol (C2H6O), é:
O trecho a seguir contextualiza a questão. Leia-o
atentamente.
Considerando a reação entre o gás carbônico e a água
dentro dos vegetais tem-se a produção de glicose e gás
oxigênio.
Indique a quantidade do volume molar, em L, de glicose ao
ser produzido 6 mols de gás oxigênio, tendo o volume
molar igual a 22,4 L.
O trecho a seguir contextualiza a questão. Leia-o atentamente.
Considerando a reação entre o gás carbônico e a água dentro dos vegetais tem-se a produção de glicose e gás oxigênio.
Reagindo 154 g de gás carbônico com 72 g de água, espera-se
a formação de 96 g de gás oxigênio. Assinale a alternativa que
compromete tal afirmação.
Certo professor misturou 5,6 g de metano e 0,4 g de hélio.
Pediu, então, que os seus alunos fizessem os cálculos das
porcentagens em massa e em mols de hélio na mistura.
Assinale a alternativa que corresponde correta e
respectivamente, em %, ao pedido realizado:
O ácido cítrico, presente em quase todos os seres vivos, é um ácido fraco, encontrado em grande
quantidade nas chamadas frutas cítricas.
Sabe-se que sua massa molar é 192 g mo1-1 e que a sua composição percentual em massa é de 37,5%
de carbono, 58,3% de oxigênio e o restante de hidrogênio. Sua fórmula molecular é, portanto,

Nos aterros sanitários, o processo de
biodegradação da matéria orgânica ocorre
geralmente em condições anaeróbicas (em
ausência de oxigênio ou de ar), produzindo
gases causadores do efeito estufa, metano e
gás carbônico, conforme mostrado na equação
abaixo, exemplificada para a glicose.

O volume de gases do efeito estufa, gerado
pela decomposição anaeróbica de 0,9 kg de
glicose nas CNTP (O °c e 1 atm), será de
aproximadamente


O ácido iodídrico, utilizado na higienização de instrumentos médicos, dentre outras aplicações,
é produzido a partir da seguinte reação química: 2 I2
+ N2
H4 → 4 HI + N2
Em um processo de produção industrial, ao adicionar 254 kg de I2
e 80 kg de N2
H4
, verifica-se o
consumo completo do reagente limitante.
A massa de reagente em excesso, que não foi consumida, em quilogramas, tem valor igual a:
A remoção de sulfeto de hidrogênio presente em amostras
de biogás é essencial, já que ele é altamente corrosivo
para tubulações metálicas. A queima desse H2S também é
muito prejudicial ao meio ambiente, pois leva à formação
de dióxido de enxofre. Um estudo de 2014 sugere que a
remoção do H2S pode ser realizada pelo uso de esponjas
de óxido de ferro, que reage com esse gás, mas pode ser
regenerado. Segundo o estudo, no dispositivo utilizado,
1,00 kg de óxido de ferro foi capaz de remover entre 0,200
e 0,716 kg de sulfeto de hidrogênio. Considere que apenas
a reação abaixo equacionada esteja ocorrendo nessa
remoção.
Fe2O3(s) + 3 H2S(g) → Fe2S3(s) + 3 H2O(l)
A partir desses dados, pode-se afirmar que, na condição
de remoção máxima de sulfeto de hidrogênio relatada no
estudo,
Massas molares (g mol-1): Fe = 56, H = 1, O = 16 e S = 32.
O Brasil é líder mundial na produção do etanol, que
substitui grande parte da gasolina. Um dos fatores a
considerar nessa substituição é a geração de CO2 no
processo global de produção e uso. O impacto na etapa
final de uso pode ser avaliado por um cálculo simplificado.
Por exemplo, um carro médio consome 1.000 g de etanol
combustível ou 700 g de gasolina comercial para percorrer
10 km. Nessas condições, a queima de 700 g de gasolina
comercial leva à formação de 1.962 g de CO2. Assim, nas
condições apresentadas, a diferença em massa de dióxido
de carbono emitido na combustão, quando se substitui a
gasolina comercial por etanol combustível, é de
aproximadamente
Dados: 1.000 gramas de etanol combustível apresentam
940 g de etanol e 60 g de água; massas molares (g mol-1):
C2H6O = 46; CO2 = 44.
Um paciente, com recomendação médica para
lúpus eritematoso, fez uso da hidroxicloroquina,
ingerindo uma dose diária de 400 mg durante 4
semanas.
Afórmula deste composto é dada a seguir.
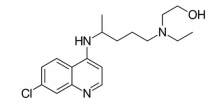
A quantidade de matéria , em mol, de
hidroxicloroquina, ingerida pelo paciente ao longo
das 4 semanas de tratamento foi de:
(Dado: massa molar da hidroxicloroquina = 335,5
g/mol)
Um paciente, com recomendação médica para lúpus eritematoso, fez uso da hidroxicloroquina, ingerindo uma dose diária de 400 mg durante 4 semanas.
Afórmula deste composto é dada a seguir.

A quantidade de matéria , em mol, de hidroxicloroquina, ingerida pelo paciente ao longo das 4 semanas de tratamento foi de:
(Dado: massa molar da hidroxicloroquina = 335,5
g/mol)
Manganês metálico é obtido industrialmente a
partir do processo representado pela equação
química a seguir:
3 Mn3O4 + 8 Al -> 9 Mn + 4 Al2O3
Em uma operação industrial, reagiu-se 13740 kg de
Mn3O4 e 6480 kg de Al. Admitindo-se o consumo do
reagente limitante por completo, a massa de Mn
formado, em quilogramas, é igual a:
Quando zinco (Zn) metálico é colocado em contato com ácido
clorídrico (HCl) ocorre uma reação de oxirredução com
liberação de gás hidrogênio (H2) conforme representado pela
reação a seguir:

Se 10,00 g de Zn foram misturados com 8,00 g de ácido
clorídrico, quantos mols de H2 foram liberados
aproximadamente:

Um determinado sólido contendo 20,0% em massa de
água necessita ser secado para produzir um sólido que
contenha no máximo 4,0% de água. A percentagem de
remoção de água do sólido original é igual a
O bicarbonato de sódio é empregado como
“fermento químico” em panificação, por sofrer a
seguinte reação de decomposição térmica não
balanceada: (Na = 23,0; H = 1,0; C = 12,0; O = 16,0 g/mol)
A termólise de 84 g do reagente produzirá a massa
de carbonato de sódio e o número de mols de
dióxido de carbono iguais a, respectivamente,
