9274fb89-02
UNIFOA 2018 - Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria., Representação das transformações químicas
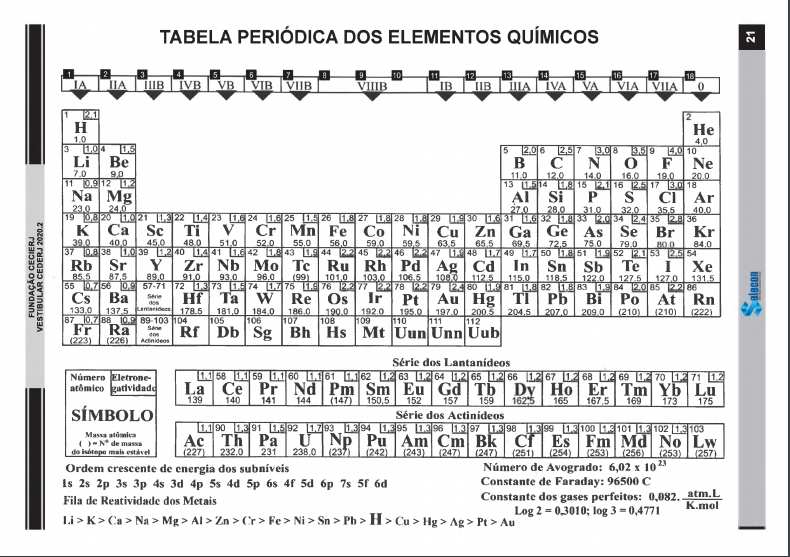
Uma das reações químicas envolvidas no refino do minério de Ferro é a do Óxido Ferroso com Monóxido de Carbono, que gera Ferro reduzido e Dióxido de Carbono, mostrada a seguir:
FeO + CO  Fe + CO2
Fe + CO2
Massas Molares:
ü FeO: 71,8 g.mol-1
ü CO: 28 g.mol-1
ü Fe: 55,8 g.mol-1
ü CO2: 44 g.mol-1
A massa de dióxido de carbono produzida para a obtenção de 111,6 g de Ferro reduzido é:
Uma das reações químicas envolvidas no refino do minério de Ferro é a do Óxido Ferroso com Monóxido de Carbono, que gera Ferro reduzido e Dióxido de Carbono, mostrada a seguir:
FeO + CO  Fe + CO2
Fe + CO2
 Fe + CO2
Fe + CO2
Massas Molares:
ü FeO: 71,8 g.mol-1
ü CO: 28 g.mol-1
ü Fe: 55,8 g.mol-1
ü CO2: 44 g.mol-1
A massa de dióxido de carbono produzida para a obtenção de 111,6 g de Ferro reduzido é:
A
223,2 g
B
143,6 g
C
88 g
D
56 g
E
22 g