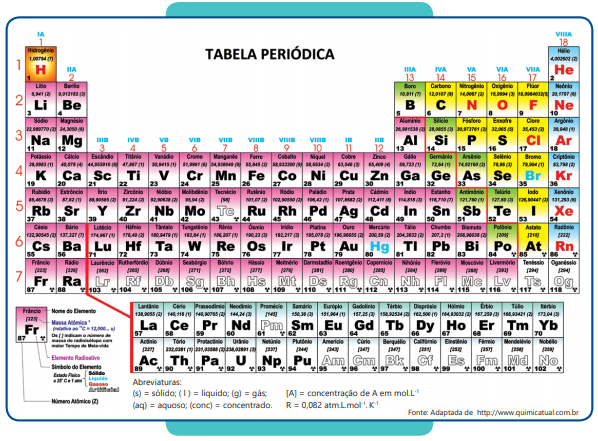
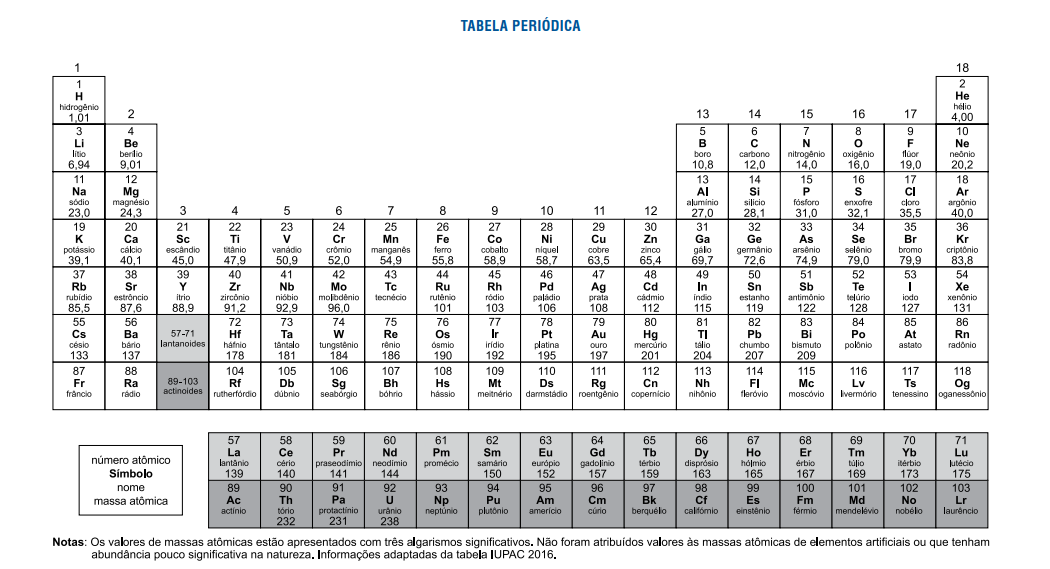
Ritalina é o nome comercial do metilfenidato,
droga frequentemente receitada para pacientes
com transtorno do déficit de atenção e
hiperatividade (TDAH). A fórmula estrutural do
fenilfenidato está representada a seguir:

A respeito dessa substância foram feitas algumas
afirmações:
I. Apresenta fórmula molecular C14H19NO2.
II. Um comprimido com 20 mg apresenta menos
de 1,0 x 10-5 mol dessa substância.
III. A molécula apresenta carbono quiral.
IV. Apresenta as funções amina e ácido carboxílico.
• Estão corretas apenas as afirmações:
Ritalina é o nome comercial do metilfenidato, droga frequentemente receitada para pacientes com transtorno do déficit de atenção e hiperatividade (TDAH). A fórmula estrutural do fenilfenidato está representada a seguir:

A respeito dessa substância foram feitas algumas afirmações:
I. Apresenta fórmula molecular C14H19NO2.
II. Um comprimido com 20 mg apresenta menos de 1,0 x 10-5 mol dessa substância.
III. A molécula apresenta carbono quiral.
IV. Apresenta as funções amina e ácido carboxílico.
• Estão corretas apenas as afirmações: