Isomeria Espacial Geométrica: o que é, como acontece e como cai no Enem
Publicado em: 18/10/2023Dentro do estudo da química orgânica, a isomeria se destaca por apresentar muitas diversidades. Alguns compostos orgânicos apresentam a mesma fórmula molecular, entretanto o arranjo espacial desses átomos pode alterar as suas características dando origem a isomeria espacial. Ressalta-se que a isomeria espacial é muito ampla, podendo então ser subdivida em isomeria geométrica e isomeria óptica. Nesse material será enfatizado a isomeria geométrica, a qual seu conhecimento é extrema importância para um bom desempenho na prova do Enem.
Condições para isomeria geométrica
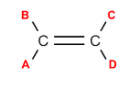
As ligações covalentes simples apresentam como característica principal a capacidade de rotacionar de maneira livre, pois não possui nenhum impedimento estérico. Desse modo, uma das condições da existência de isomeria geométrica em compostos de cadeia aberta é a presença de pelo menos uma ligação dupla entre carbonos. Além disso, os carbonos presentes nessa dupla ligação devem apresentar dois ligantes diferentes para haver a possibilidade de formação dos isômeros cis e trans. No exemplo hipotético abaixo observa-se que só haverá condições adequadas para formação de isômeros caso A for diferente de B e se C for diferente de D.
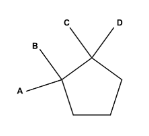
Assim como nas ligações covalentes duplas, as ligações de compostos orgânicos cíclicos também apresentam impedimento espacial para a rotação, sendo dessa forma uma das condições para haver isomeria geométrica. Ressalta-se que para que os compostos cíclicos apresentam isomeria espacial é necessário que pelo menos dois carbonos envolvidos em uma das ligações possuem dois ligantes diferentes entre si. Assim, para o exemplo genérico abaixo pode-se inferir que só existirá isômeros espaciais caso A ≠ B e C ≠ D.
Isomeria geométrica cis-trans
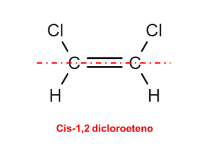
A isomeria cis-trans ocorre em compostos que apresentam pelo menos uma ligação dupla ou em compostos cíclicos. O isômero cis é aquele em que os ligantes iguais dos dois carbonos envolvidos estão do mesmo lado da ligação como ocorre no cis-1,2 dicloroeteno.
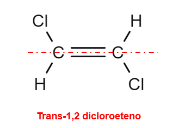
Consequentemente, os isômeros trans são aqueles nos quais os ligantes iguais se localizam em lados opostos da ligação química, o que é o caso do trans-1,2 dicloroeteno.
Salienta-se que para compostos cíclicos o mesmo raciocínio se aplica, onde o isômero que apresenta os ligante iguais do mesmo lado da ligação entre os carbonos recebe a termologia cis, enquanto o isômero que apresenta os dois ligante iguais em lados opostos da ligação recebe o nome de trans. Embora visualmente a diferença entre os isômeros cis-trans seja pequena, ao se analisar as características e propriedades dos isômeros é possível perceber que as propriedades químicas e físicas são bem diferentes.
Isomeria geométrica E-Z
Quando falamos sobre isomeria de compostos orgânicos, é importante lembrar que inúmeras substâncias podem ser formadas e muitas delas possuem as condições necessárias para a existência da isomeria cis-trans, entrentanto em alguns casos os ligantes dos carbonos podem não ser iguais, o que atrapalha a classificação como cis e trans. Pensando nisso, a classificação em isômeros E e Z se mostra mais ampla, conseguindo envolver várias substâncias químicas. Nessa classificação, o isômero E apresenta os dois ligantes com maior número atômico de lados opostos (E vêm do alemão entgegen que significa oposto). Entretanto, se os dois ligantes com maior número atômico estiverem no mesmo lado do plano da ligação, temos o isômero Z (Z vem do alemão zusammen que significa juntos).
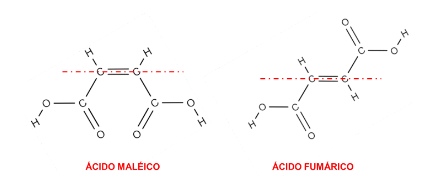
O ácido maleico é uma substância orgânica da classe dos ácidos carboxílicos que apresenta as carboxilas como grupos funcionais de maiores números atômicos e como elas estão do mesmo lado da dupla ligação é considerado o isômero E. Em contrapartida, o ácido fumárico apresenta a mesma fórmula molecular do ácido maleico, diferenciando-se então pelo arranjo espacial das carboxilas que se localizam nos lados opostos da ligação dupla, sendo, portanto, o isômero Z. A classificação de isomeria E/Z é muito utilizada quando se quer determinar com maior precisão a organização espacial das ligações químicas dos compostos orgânicos.
Isomeria geométrica no Enem
A isomeria é um dos conteúdos de química mais abordados nos vestibulares e no Enem não é diferente. Para os candidatos que desejam ter um bom rendimento nas provas é indispensável entender o que é isomeria geométrica e principalmente entender como é a abordagem da isomeria geométrica no Enem. Ressalta-se que o exame nacional do ensino médio geralmente busca trazer uma situação cotidiana em que os isômeros geométricos são utilizados, sendo importante o candidato saber identificar na fórmula molecular dos compostos orgânicos as condições necessárias para existência de isomeria geométrica.
(ENEM 2018) Pesquisas demonstram que nanodispositivos baseados em movimentos de dimensões atômicas, induzidos por luz, poderão ter aplicações em tecnologias futuras, substituindo micromotores, sem a necessidade de componentes mecânicos. Exemplo de movimento molecular induzido pela luz pode ser observado pela flexão de uma lâmina delgada de silício, ligado a um polímero de azobenzeno e a um material suporte, em dois comprimentos de onda, conforme ilustrado na figura. Com a aplicação de luz ocorrem reações reversíveis da cadeia do polímero, que promovem o movimento observado.
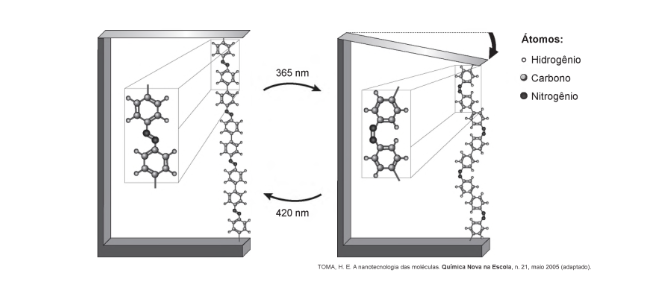
O fenômeno de movimento molecular, promovido pela incidência de luz, decorre do(a)
a) movimento vibracional dos átomos, que leva ao encurtamento e à relaxação das ligações.
b) isomerização das ligações N=N, sendo a forma cis do polímero mais compacta que a trans.
c) tautomerização das unidades monoméricas do polímero, que leva a um composto mais compacto.
d) ressonância entre os elétrons π do grupo azo e os do anel aromático que encurta as ligações duplas.
e) variação conformacional das ligações N=N, que resulta em estruturas com diferentes áreas de superfície.