Questõesde UEFS sobre Química

A tabela apresenta os valores de densidades, massa molar
e entalpia molar de combustão de alguns combustíveis.
Considerando-se essas informações e com base nos
conhecimentos de termoquímica, é correto afirmar:

A tabela apresenta os valores de densidades, massa molar e entalpia molar de combustão de alguns combustíveis.
Considerando-se essas informações e com base nos conhecimentos de termoquímica, é correto afirmar:
Cl.(g) + O3(g) → ClO(g) + O2(g)
Os CFCs, utilizados como propelentes em sprays, ao atingirem
a estratosfera, se decompõem sobre ação da radiação
ultravioleta. Durante esse processo, átomos livres de cloro são
formados e, ao reagirem com ozônio, O3(g), de acordo com a
equação química, resumida, provocam a redução da
concentração desse gás, diminuindo, assim, a proteção do
planeta contra radiações ultravioleta.
Considerando-se essas informações, é correto afirmar:
Fe2+(aq) + HCO-3 + O2(aq) → Fe2O3(s) + CO2(g) + H2O(l)
A presença de sais de ferro, a exemplo de bicarbonato de
ferro (II), Fe(HCO3)2(aq), na água de abastecimento, deixa
manchas de cor marrom quando a água goteja sobre a
superfície de azulejos, pisos e vasos sanitários, em razão da
formação de depósitos de óxido de ferro (III), Fe2O3(s).
Após análise dessas informações e do balanceamento da
equação química com coeficientes estequiométricos inteiros,
é correto afirmar:
Fe2+(aq) + HCO-3 + O2(aq) → Fe2O3(s) + CO2(g) + H2O(l)
A presença de sais de ferro, a exemplo de bicarbonato de ferro (II), Fe(HCO3)2(aq), na água de abastecimento, deixa manchas de cor marrom quando a água goteja sobre a superfície de azulejos, pisos e vasos sanitários, em razão da formação de depósitos de óxido de ferro (III), Fe2O3(s).
Após análise dessas informações e do balanceamento da
equação química com coeficientes estequiométricos inteiros,
é correto afirmar:
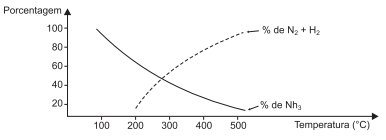
N2(g) + 3H2(g)  2NH3(g) ΔHº = − 109,5kJ
2NH3(g) ΔHº = − 109,5kJ
O gráfico mostra a variação do rendimento de amônia com a
variação da temperatura de acordo com o sistema em equilíbrio
químico, a 100,0atm, representado pela equação termoquímica.
Uma análise desse gráfico e do sistema em equilíbrio químico
representado pela equação termoquímica permite afirmar:

N2(g) + 3H2(g) 2NH3(g) ΔHº = − 109,5kJ
O gráfico mostra a variação do rendimento de amônia com a
variação da temperatura de acordo com o sistema em equilíbrio
químico, a 100,0atm, representado pela equação termoquímica.
Uma análise desse gráfico e do sistema em equilíbrio químico representado pela equação termoquímica permite afirmar:
Um ácido e uma base sempre atuam juntos na transferência
de próton, isto é, uma substância pode agir como ácido apenas
se outra substância comporta-se como uma base.
A partir da compreensão dessa informação, é correto afirmar:
A base conjugada de PH+4 (aq) é P(OH)3(aq).
(CoCl4)
2−
(s) + 6H2O(l) [Co(H2O)6]
2+(aq) + 4Cl−
(aq) ΔHº=−504kJ
As pequenas esferas azuis de sílica gel utilizadas como
desumidificadores no transporte e na proteção de aparelhos
eletroeletrônicos, em atmosfera úmida, absorve água do
ambiente tornando-se cor de rosa. Ao serem aquecidas em
uma estufa, voltam a ter a cor azul inicial de acordo com o
sistema em equilíbrio químico representado pela equação
química.
A análise desse sistema em equilíbrio químico e das
informações referidas no texto permite afirmar:
(CoCl4) 2− (s) + 6H2O(l) [Co(H2O)6] 2+(aq) + 4Cl− (aq) ΔHº=−504kJ
As pequenas esferas azuis de sílica gel utilizadas como desumidificadores no transporte e na proteção de aparelhos eletroeletrônicos, em atmosfera úmida, absorve água do ambiente tornando-se cor de rosa. Ao serem aquecidas em uma estufa, voltam a ter a cor azul inicial de acordo com o sistema em equilíbrio químico representado pela equação química.
A análise desse sistema em equilíbrio químico e das
informações referidas no texto permite afirmar:

O químico inglês Robert Boyle investigou a relação entre a
pressão de uma massa gasosa e seu volume à temperatura
constante. Para atingir esse objetivo, realizou uma série de
experiências utilizando um manômetro em forma de “jota” com
uma extremidade aberta, como mostra a figura I e II. Boyle
variou a pressão sobre o gás adicionando mercúrio dentro do
tubo e, com os dados experimentais, estabeleceu uma relação
empírica entre pressão e volume de uma massa gasosa.
Admitindo-se que o gás utilizado por Boyle é ideal, uma análise
dessas considerações permite afirmar:

O químico inglês Robert Boyle investigou a relação entre a pressão de uma massa gasosa e seu volume à temperatura constante. Para atingir esse objetivo, realizou uma série de experiências utilizando um manômetro em forma de “jota” com uma extremidade aberta, como mostra a figura I e II. Boyle variou a pressão sobre o gás adicionando mercúrio dentro do tubo e, com os dados experimentais, estabeleceu uma relação empírica entre pressão e volume de uma massa gasosa.
Admitindo-se que o gás utilizado por Boyle é ideal, uma análise dessas considerações permite afirmar:
 T.
T.Com objetivo de comprovar a Lei de Conservação das Massas
em uma reação química — Lei de Lavoisier —, um béquer de
125,0mL, contendo uma solução diluída de ácido sulfúrico,
H2SO4(aq), foi pesado juntamente com um vidro de relógio,
contendo pequena quantidade de carbonato de potássio,
K2CO3(s), que, em seguida, foi adicionado à solução ácida.
Terminada a reação, o béquer com a solução e o vidro de
relógio vazio foram pesados, verificando-se que a massa final,
no experimento, foi menor que a massa inicial.
Considerando-se a realização desse experimento, a conclusão
correta para a diferença verificada entre as massas final e
inicial é
Para desenhar a estrutura molecular de BrF3, pelo modelo de
repulsão dos pares eletrônicos da camada de valência, é
preciso escrever a estrutura de Lewis e, em seguida, identificar
o número de pares de elétrons ligantes e não ligantes.
A partir dessas informações, é correto afirmar:
A estrutura de Lewis para a molécula de BrF3 é
representada pela fórmula 
A forma geométrica da molécula BrF3 é uma bipirâmide
trigonal representada pela fórmula estrutural 
O elemento químico índio é utilizado na dopagem de cristais,
na fabricação de transistores e em soldas de baixo ponto de
fusão aplicadas em chips de semicondutores, a exemplo de
silício.
Com base nos conhecimentos dos modelos atômicos e nas
propriedades periódicas dos elementos químicos, é correto
afirmar:
Em 1913, Henry G. J. Moseley estabeleceu o conceito de
número atômico, verificando que esse número caracterizava
melhor um elemento químico do que sua massa atômica e,
a partir dessa constatação, a lei da periodicidade de Dimitri
J. Mendeleyev ganhou um novo enunciado: muitas
propriedades físicas e químicas dos elementos químicos
variam, periodicamente, na sequência de seus números
atômicos.
Com base nessas considerações e comparando-se as
propriedades dos elementos químicos rubídio e iodo, é correto
afirmar:
Os componentes de uma mistura podem ser separados de
acordo com suas propriedades físicas e técnicas que fazem
parte de uma variedade de processos físicos de análise
imediata.
Assim, para a separação dos componentes da mistura de
areia com serragem de madeira, a melhor técnica é a

Os diamantes são um vício. Os iniciados que caem na
sedução que emana deles têm diante de pedras poderosas
a mesma descarga de adrenalina dos jogadores diante de um
lance memorável. O coração dispara, as mãos tremem e, por
alguns instantes, nada mais existe no mundo. Da mesma jazida
de Letseng, no Lesoto, Sul da África, saíram, nos últimos cinco
anos, três diamantes gigantescos: o Promesse de Lesoto, 603
quilates, Legado de Letseng, 493 quilates, e Luz de Letseng,
478 quilates. O diamante e o grafite não só possuem aspectos
diferentes, como também propriedades diferentes.
A partir dessas informações, é correto afirmar:

Os diamantes são um vício. Os iniciados que caem na
sedução que emana deles têm diante de pedras poderosas
a mesma descarga de adrenalina dos jogadores diante de um
lance memorável. O coração dispara, as mãos tremem e, por
alguns instantes, nada mais existe no mundo. Da mesma jazida
de Letseng, no Lesoto, Sul da África, saíram, nos últimos cinco
anos, três diamantes gigantescos: o Promesse de Lesoto, 603
quilates, Legado de Letseng, 493 quilates, e Luz de Letseng,
478 quilates. O diamante e o grafite não só possuem aspectos
diferentes, como também propriedades diferentes.
A partir dessas informações, é correto afirmar:

A quinina, um alcaloide representado pela fórmula estrutural e utilizado no tratamento da malária sob forma de sulfato, é extraída
da Chinchona ledgeriana, um arbusto da família das rubiáceas, originado dos Andes.
Considerando-se essas informações sobre a quinina, é correto afirmar:

A quinina, um alcaloide representado pela fórmula estrutural e utilizado no tratamento da malária sob forma de sulfato, é extraída da Chinchona ledgeriana, um arbusto da família das rubiáceas, originado dos Andes.
Considerando-se essas informações sobre a quinina, é correto afirmar: