Questõessobre Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess.
Considere os calores de combustão apresentados na tabela
a seguir:
Substância ΔH combustão (kcal/mol)
C2H4(g) -337,3
H2(g) -68,3
C2H6(g) -372,8
O valor da variação de entalpia na hidrogenação catalítica do eteno,
descrita pela reação abaixo, é:
C2H4(g) + H2(g) → C2H6(g)
A bolsa térmica que está disponível no comércio funciona da seguinte forma: [...] O usuário
deve acionar uma pequena placa metálica flexível que existe no interior da bolsa para dar
início ao processo de aquecimento. Feito isso, o líquido que preenche a bolsa vai se
cristalizando e a temperatura aumenta até atingir 50º C. No rótulo do produto, leem-se as
informações: contém acetato de sódio; pressione o disco metálico, antes de usar; para usar
novamente, aqueça a bolsa em água fervente.
LIMA, M. E. C. C.; DAVID, M. A.; MAGALHÃES, W. F de. Ensinar Ciências por investigação: um desafio para os
formadores. Química Nova na Escola, n. 29, ago. 2009. p. 25. Adaptado.
De acordo com o texto, marque a alternativa que apresenta uma informação INCORRETA sobre o que
ocorre na bolsa térmica.

Ao se misturar 100 mL de HCl 1/mol/L com100 mL de NaOH de mesma concentração,obtém-se uma solução de NaCl (sal de cozinha) e observa-se claramente um aumento de temperatura.
Diante do exposto, pode-se afirmar que se trata de uma reação

Ao se misturar 100 mL de HCl 1/mol/L com100 mL de NaOH de mesma concentração,obtém-se uma solução de NaCl (sal de cozinha) e observa-se claramente um aumento de temperatura.
Diante do exposto, pode-se afirmar que se trata de uma reação

Considere as reações 1 e 2 abaixo:
(Reação 1) 6 CO2
+ 6 H2O + Energia → C6
H12O6 + 6 O2
(Reação 2) C6
H12O6 + 6 O2 → 6 CO2
+ 6 H2
O + Energia
Com relação às reações apresentadas, é INCORRETO
afirmar que
Considere as reações 1 e 2 abaixo:
(Reação 1) 6 CO2 + 6 H2O + Energia → C6 H12O6 + 6 O2
(Reação 2) C6 H12O6 + 6 O2 → 6 CO2 + 6 H2 O + Energia
Com relação às reações apresentadas, é INCORRETO afirmar que
A maior parte da energia de que o nosso corpo necessita vem da combustão de carboidratos por meio
da respiração celular. O corpo utiliza a energia para
contrair os músculos, construir e reparar os tecidos e
manter a temperatura corporal. O excesso é armazenado como gordura, reserva de energia para o corpo.
A composição de óleos e gorduras, de origem animal
ou vegetal, comumente indicados nas embalagens
dos alimentos, é expressa como “gorduras”. Um tipo
de óleo vegetal geralmente usado pela população é
o óleo de soja. Considere a fórmula do óleo de soja
como sendo C56H100O6
(massa molar = 868 g/mol) e
os dados da tabela a seguir:

A partir dos dados, conclui-se que a energia liberada
na combustão completa de 1g do referido óleo de soja
é de aproximadamente
A maior parte da energia de que o nosso corpo necessita vem da combustão de carboidratos por meio da respiração celular. O corpo utiliza a energia para contrair os músculos, construir e reparar os tecidos e manter a temperatura corporal. O excesso é armazenado como gordura, reserva de energia para o corpo. A composição de óleos e gorduras, de origem animal ou vegetal, comumente indicados nas embalagens dos alimentos, é expressa como “gorduras”. Um tipo de óleo vegetal geralmente usado pela população é o óleo de soja. Considere a fórmula do óleo de soja como sendo C56H100O6 (massa molar = 868 g/mol) e os dados da tabela a seguir:

A partir dos dados, conclui-se que a energia liberada
na combustão completa de 1g do referido óleo de soja
é de aproximadamente
Leia o texto e analise a tabela sobre entalpias de
ligação para responder à questão.
O lixo urbano pode ser usado para a produção de
uma importante fonte de energia, o metano. Essa
substância é produzida na decomposição anaeróbica da matéria orgânica, podendo ser usada como
combustível em veículos e na indústria.

Considerando os valores aproximados das entalpias
de ligação apresentados na tabela, em relação ao
metano é possível afirmar que
Leia o texto e analise a tabela sobre entalpias de ligação para responder à questão.
O lixo urbano pode ser usado para a produção de uma importante fonte de energia, o metano. Essa substância é produzida na decomposição anaeróbica da matéria orgânica, podendo ser usada como combustível em veículos e na indústria.

Considerando os valores aproximados das entalpias
de ligação apresentados na tabela, em relação ao
metano é possível afirmar que
A produção de muitos dos alimentos e bebidas mais
apreciados envolve processos fermentativos. A produção do vinho e da cerveja, realizada com auxílio
do Saccharomyces cerevisiae, é um exemplo. Esse
micro-organismo é capaz de alimentar-se de açúcares simples, como a glicose, produzindo etanol e
dióxido de carbono, como mostra a equação química
não balanceada a seguir.
C6
H12O6 → CH3
CH2
OH + CO2
Sobre esse assunto, é correto afirmar que
A produção de muitos dos alimentos e bebidas mais apreciados envolve processos fermentativos. A produção do vinho e da cerveja, realizada com auxílio do Saccharomyces cerevisiae, é um exemplo. Esse micro-organismo é capaz de alimentar-se de açúcares simples, como a glicose, produzindo etanol e dióxido de carbono, como mostra a equação química não balanceada a seguir.
C6 H12O6 → CH3 CH2 OH + CO2
Sobre esse assunto, é correto afirmar que
A nitroglicerina - C3H5(NO3)3 – é um nitrato de alquila, descoberta em 1847 por Ascanio
Sobrero (químico italiano, 1812-1888), que a obteve misturando glicerina, ácido nítrico e ácido
sulfúrico. No estado puro e à temperatura ambiente, a nitroglicerina é um líquido muito
explosivo e perigoso. Em 1867, Alfred Nobel (químico sueco, 1833-1896) realizou testes no
sentido de melhorar a manipulação da nitroglicerina, misturando-a com materiais inertes, como
sílica, pós cerâmicos, argila, gesso, carvão e terras diatomáceas. Esses materiais, agora
moldáveis, viriam a se tornar um explosivo muito importante, conhecido como dinamite.
A equação abaixo (não balanceada) representa a reação de decomposição da nitroglicerina:
C3H5(NO3)3(l) → N2(g) + O2(g) + CO2(g) + H2O(g) (não balanceada)
Dados: ∆Hf C3H5(NO3)3(l) = -364 kJ/mol; ∆Hf CO2(g) = -393 kJ/mol; ∆Hf H2O(g)= -242 kJ/mol
De posse das informações, assinale a alternativa que representa a variação de entalpia da
reação acima, em kJ por mol de nitroglicerina.
A nitroglicerina - C3H5(NO3)3 – é um nitrato de alquila, descoberta em 1847 por Ascanio Sobrero (químico italiano, 1812-1888), que a obteve misturando glicerina, ácido nítrico e ácido sulfúrico. No estado puro e à temperatura ambiente, a nitroglicerina é um líquido muito explosivo e perigoso. Em 1867, Alfred Nobel (químico sueco, 1833-1896) realizou testes no sentido de melhorar a manipulação da nitroglicerina, misturando-a com materiais inertes, como sílica, pós cerâmicos, argila, gesso, carvão e terras diatomáceas. Esses materiais, agora moldáveis, viriam a se tornar um explosivo muito importante, conhecido como dinamite.
A equação abaixo (não balanceada) representa a reação de decomposição da nitroglicerina:
C3H5(NO3)3(l) → N2(g) + O2(g) + CO2(g) + H2O(g) (não balanceada)
Dados: ∆Hf C3H5(NO3)3(l) = -364 kJ/mol; ∆Hf CO2(g) = -393 kJ/mol; ∆Hf H2O(g)= -242 kJ/mol
De posse das informações, assinale a alternativa que representa a variação de entalpia da reação acima, em kJ por mol de nitroglicerina.
A glicose (C6H12O6
) provê energia, na forma de calor,
equivalente a 2.600 kJ por 1 mol. Um jogador de futebol
precisa de 20.280 kJ por dia, quando em competição. Ao
considerar a energia obtida em termos da massa de glicose consumida, em gramas, o mínimo desse açúcar que o
jogador deve ingerir é de, aproximadamente,


Considere as seguintes afirmações sobre
termoquímica.
I - A vaporização do etanol é um processo
exotérmico.
II - Os produtos de uma reação de combustão
têm entalpia inferior aos reagentes.
III- A reação química da cal viva (óxido de
cálcio) com a água é um processo em que
ocorre absorção de calor.
Quais estão corretas?
II - Os produtos de uma reação de combustão têm entalpia inferior aos reagentes.
III- A reação química da cal viva (óxido de cálcio) com a água é um processo em que ocorre absorção de calor.
No gráfico a seguir, é apresentada a variação da energia durante uma reação química hipotética.
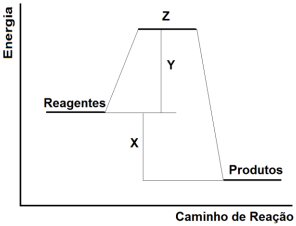
Com base no gráfico, pode-se correlacionar X, Y e Z, respectivamente, como
No gráfico a seguir, é apresentada a variação da energia durante uma reação química hipotética.

Com base no gráfico, pode-se correlacionar X, Y e Z, respectivamente, como
O carbonato de cálcio (CaCO3) é, recentemente, um dos principais compostos pesquisados na área de
materiais, sobretudo em cerâmicas, como na produção de tijolos. Uma das maneiras de produção do
CaCO3 é pela reação entre o hidróxido de cálcio, Ca(OH)2, e de ácido carbônico, H2CO3 conforme esta
equação:
H2CO3(aq) + Ca(OH)2(aq) → CaCO3(s) + 2 H2O(l) Equação 1
São apresentadas as entalpias-padrão de reação, em kJmol-1
, para três reações a 25°C:
I - CaO(s) + CO2(g) → CaCO3 (s) ΔH° = -183,3 kJmol-1
Equação 2
II - CaO (s) + H2O(l) → Ca(OH)2(aq) ΔH° = - 82,4 kJmol-1
Equação 3
III - CO2 (g) + H2O(l) →H2CO3(aq) ΔH° = - 20,5 kJmol-1
Equação 4
O valor da entalpia-padrão, em kJ, para a produção do carbonato na reação da equação 1 é:
O carbonato de cálcio (CaCO3) é, recentemente, um dos principais compostos pesquisados na área de materiais, sobretudo em cerâmicas, como na produção de tijolos. Uma das maneiras de produção do CaCO3 é pela reação entre o hidróxido de cálcio, Ca(OH)2, e de ácido carbônico, H2CO3 conforme esta equação:
H2CO3(aq) + Ca(OH)2(aq) → CaCO3(s) + 2 H2O(l) Equação 1
São apresentadas as entalpias-padrão de reação, em kJmol-1 , para três reações a 25°C:
I - CaO(s) + CO2(g) → CaCO3 (s) ΔH° = -183,3 kJmol-1 Equação 2
II - CaO (s) + H2O(l) → Ca(OH)2(aq) ΔH° = - 82,4 kJmol-1 Equação 3
III - CO2 (g) + H2O(l) →H2CO3(aq) ΔH° = - 20,5 kJmol-1 Equação 4

8Li(s) + SF6(g) → Li2S(s) + 6LiF(s)
Com base nos conhecimentos da Química, considerando-se a tecnologia de adaptação de energia química armazenada para
ogivas de torpedos, desenvolvida pela Marinha dos EUA, relacionando-a às informações do texto e à equação química, é correto
concluir:

8Li(s) + SF6(g) → Li2S(s) + 6LiF(s)
Com base nos conhecimentos da Química, considerando-se a tecnologia de adaptação de energia química armazenada para ogivas de torpedos, desenvolvida pela Marinha dos EUA, relacionando-a às informações do texto e à equação química, é correto concluir:
Observe a equação de formação de etanol a seguir:
2 Cgraf + 3 H2(g) + ½ O2(g) → C2
H6
O(l)
Com base nas equações abaixo que resultam na reação de interesse, calcule o ∆H da reação de
formação do etanol.
I. Cgraf + O2(g) → CO2(g) ∆H = -394 kJ/mol
II. H2(g) + ½ O2(g) → H2
O(l) ∆H = -286 kJ/mol
III. C2
H6
O(l) + 3 O2(g) → 2 CO2(g) + 3 H2
O(l) ∆H = -1368 kJ/mol
Observe a equação de formação de etanol a seguir:
2 Cgraf + 3 H2(g) + ½ O2(g) → C2 H6 O(l)
Com base nas equações abaixo que resultam na reação de interesse, calcule o ∆H da reação de formação do etanol.
I. Cgraf + O2(g) → CO2(g) ∆H = -394 kJ/mol
II. H2(g) + ½ O2(g) → H2 O(l) ∆H = -286 kJ/mol
III. C2
H6
O(l) + 3 O2(g) → 2 CO2(g) + 3 H2
O(l) ∆H = -1368 kJ/mol
O uso de hidrogênio, como combustível para automóveis, é uma das apostas da indústria
automobilística para o futuro, já que a queima do gás hidrogênio libera apenas água como
produto da reação e uma grande quantidade de calor. A reação de combustão do gás
hidrogênio é apresentada abaixo.
2 H2(g) + O2(g) → 2 H2O(g) ∆H= - 483,6 kJ
A reação acima é uma reação:
À pressão de 1 atm, as entalpias de fusão e a de vaporização da água são, respectivamente,
6,0 kJ/mol e 40,6 kJ/mol, as temperaturas de fusão e vaporização, são, respectivamente, 0ºC e
100°C. As densidades do gelo e da água, ambos a 0°C, são, respectivamente, 0,92g/mL e
1,00 g/mL.
Acerca dessas informações, assinale a alternativa incorreta.
Um palito de fósforo queima transformando trissulfeto de
tetrafósforo em pentóxido de difósforo e dióxido de enxofre, de acordo com a reação termoquímica a seguir.
P4
S3(s) + 8 O2(g) → 2 P2
O5(s) + 3 SO2(g); ΔH° = -3680 kJ mol-1
Um palito de fósforo contém 200 mg de P4
S3
, logo a sua
combustão libera energia, cujo valor em joules é mais
próximo de
Dados
MP = 31 g mol-1
MS = 32 g mol L-1
Um palito de fósforo queima transformando trissulfeto de tetrafósforo em pentóxido de difósforo e dióxido de enxofre, de acordo com a reação termoquímica a seguir.
P4 S3(s) + 8 O2(g) → 2 P2 O5(s) + 3 SO2(g); ΔH° = -3680 kJ mol-1
Um palito de fósforo contém 200 mg de P4 S3 , logo a sua combustão libera energia, cujo valor em joules é mais próximo de
Dados
MP = 31 g mol-1
MS = 32 g mol L-1
O carbonato de cálcio (CaCO3) é, recentemente, um dos principais compostos pesquisados na área de
materiais, sobretudo em cerâmicas, como na produção de tijolos. Uma das maneiras de produção do
CaCO3 é pela reação entre o hidróxido de cálcio, Ca(OH)2, e de ácido carbônico, H2CO3 conforme esta
equação:
H2CO3(aq) + Ca(OH)2(aq) → CaCO3(s) + 2 H2O(l) Equação 1
São apresentadas as entalpias-padrão de reação, em kJmol-1
, para três reações a 25ºC:
I - CaO(s) + CO2(g) → CaCO3 (s) ΔHº = -183,3 kJmol-1 Equação 2
II - CaO (s) + H2O(l) → Ca(OH)2(aq) ΔHº = - 82,4 kJmol-1 Equação 3
III - CO2(g) + H2O(l) → H2CO3(aq) ΔHº = - 20,5 kJmol-1 Equação 4
O valor da entalpia-padrão, em kJ, para a produção do carbonato na reação da equação 1 é:
Na Figura abaixo, é mostrada a reação de adição do bromo (Br2
) ao estireno.

Considerando os valores de entalpia de ligação da Tabela,
o valor da entalpia de reação, em kJ mol-1
, será:
Na Figura abaixo, é mostrada a reação de adição do bromo (Br2 ) ao estireno.

Considerando os valores de entalpia de ligação da Tabela,
o valor da entalpia de reação, em kJ mol-1
, será: