Questõessobre Substâncias Inorgânicas: dissociação iônica e ionização, conceitos de ácido-base.
O ácido fosfórico é um dos componentes
presentes em determinados tipos de
refrigerantes, formando uma solução com
concentração igual a 0,49 g/L. Em relação ao
que foi apresentado, assinale a alternativa
correta:
Informa a publicação norte-americana Popular
Science que cientistas chineses usam pontas de
cigarro para o tratamento da corrosão em
oleodutos. O cigarro, além da nicotina, produz
monóxido de carbono, amônia, tolueno, cetonas,
cádmio, fósforo, alcatrão, polônio, níquel,
benzeno, naftalina, etc. Com base na leitura do
texto e em seus conhecimentos de química,
assinale a afirmação verdadeira.

Muitos ácidos, incluindo o ácido cianídrico, HCN, não reagem completamente em água, sendo, portanto,
um ácido fraco. A água e o HCN reagem e produzem um sistema ácido-base conjugado. Sobre esse sistema,
é CORRETO afirmar:
No processo de tratamento de água para abastecimento público, é comum utilizar sulfato de alumínio para
provocar a coagulação/floculação dos materiais finos em suspensão. Ao ser adicionado à água o sulfato de
alumínio produz íons Al3+ e SO42-. Os íons Al3+ reagem com a água produzindo hidróxido de alumínio Al(OH)3 ,
que é o responsável pela coagulação/floculação. Esta reação está representada de modo simplificado abaixo:
Al2(SO4)3 + 6H2O → 2Al(OH)3 + 6 H+
+ 3SO42-
O excesso de íons H+
formado tende a diminuir o pH do meio, o que pode contribuir para a interrupção
da formação do Al(OH)3, atrapalhando o processo de coagulação/floculação. Em alguns casos, o excesso de H+
é removido pela alcalinidade presente nas águas naturais. Se a alcalinidade do meio não for suficiente, o pH
deve ser aumentado pela adição de outras substâncias. Disponível em: <http://qnesc.sbq.org.br/online/cadernos/01/aguas.pdf> Acesso em: 1 nov. 2011 (adaptado).
É possível aumentar o pH do meio aquoso adicionando-se a seguinte substância:
Ácido Halogenídrico Constante de ionização, Ka, a 25º C
HF (aq) 6,0.10-4
HC (aq) 1,0.107
HBr (aq) 1,0.109
HI (aq) 3,0.109
A tabela relaciona os valores da constante de ionização, Ka,
dos ácidos halogenídricos.
A partir da análise dessa tabela, é correto afirmar:
Ácido Halogenídrico Constante de ionização, Ka, a 25º C
HF (aq) 6,0.10-4
HC (aq) 1,0.107
HBr (aq) 1,0.109
HI (aq) 3,0.109
A tabela relaciona os valores da constante de ionização, Ka, dos ácidos halogenídricos.
A partir da análise dessa tabela, é correto afirmar:
I. CaC2(s) + N2(g) 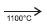 CaNCN(s) + C(s)
CaNCN(s) + C(s)
II. CaNCN(s) + 5H2O(ℓ) → CaCO3(s) + 2NH4OH(aq)
Quando carbeto de cálcio, CaC2, é aquecido em um forno
elétrico, na presença de nitrogênio atmosférico, a 1100ºC, dá
origem à cianamida de cálcio, empregada largamente como
fertilizante nitrogenado de ação lenta, pois leva alguns meses,
no solo, para se hidrolisar de acordo com a equação
química II. Como a cianamida de cálcio não é arrastada pelas
chuvas, é um fertilizante melhor do que o nitrato de amônio,
NH4NO3, e a ureia, CO(NH2)2.
Uma análise dessas informações permite afirmar:
I. CaC2(s) + N2(g) 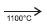 CaNCN(s) + C(s)
CaNCN(s) + C(s)
II. CaNCN(s) + 5H2O(ℓ) → CaCO3(s) + 2NH4OH(aq)
Quando carbeto de cálcio, CaC2, é aquecido em um forno elétrico, na presença de nitrogênio atmosférico, a 1100ºC, dá origem à cianamida de cálcio, empregada largamente como fertilizante nitrogenado de ação lenta, pois leva alguns meses, no solo, para se hidrolisar de acordo com a equação química II. Como a cianamida de cálcio não é arrastada pelas chuvas, é um fertilizante melhor do que o nitrato de amônio, NH4NO3, e a ureia, CO(NH2)2.
Uma análise dessas informações permite afirmar:
Algumas espécies de cogumelos liberam oct-1-en-3-ol, uma
substância que atua como repelente natural de lesmas.
A partir dessa informação, é correto afirmar:
O dihidrogenofosfato de sódio, NaH2PO4, é um conservante
utilizado em alimentos.
Em relação a esse conservante, é correto afirmar:
O dihidrogenofosfato de sódio, NaH2PO4, é um conservante utilizado em alimentos.
Em relação a esse conservante, é correto afirmar:
É base conjugada do ácido fosfórico, sob forma de íon H2PO-4.
A amônia tem sido usada desde 1860, como agente refrigerante, menos nocivo que os CFCs;
quando em solução aquosa, é conhecida como
amoníaco. Sobre as propriedades e a estrutura do
amoníaco, marque a afirmação verdadeira.
Existem muitas substâncias químicas que são
classificadas como ácidos. O aumento da acidez da
água de rios e lagos pode causar a morte de
grandes populações de peixes. Essa acidificação
pode ser consequência do despejo direto de
resíduos industriais na água, ou de chuva ácida. De
acordo com a teoria de Arrhenius sobre os ácidos,
assinale a afirmação correta.
Para explorar convenientemente a cultura da soja, é indispensável incorporar calcário aos solos
que estão com pH inferior a 5,5. A quantidade de calcário a ser aplicada no terreno é determinada
através da análise do solo.
Considerando-se essas informações, é INCORRETO afirmar que
Para explorar convenientemente a cultura da soja, é indispensável incorporar calcário aos solos que estão com pH inferior a 5,5. A quantidade de calcário a ser aplicada no terreno é determinada através da análise do solo.
Considerando-se essas informações, é INCORRETO afirmar que
O hidróxido de cálcio, Ca(OH)2
, pode ser neutralizado com H2SO4, de acordo com a equação química balanceada representada a seguir:
H2
SO4 (aq) + Ca(OH)2(aq) → CaSO4(aq) + 2 H2O(l)
A respeito das espécies químicas que participam dessa reação de neutralização, verifica-se que o
Determinadas substâncias químicas sofrem ionização em água, resultando em uma solução classificada como
eletrolítica capaz de conduzir corrente elétrica. Entre as alternativas abaixo, assinale a que apresenta somente
espécies que sofrem ionização na água.
Considerando, além das informações do texto e da tabela acima, que as alquilações de Friedel-Crafts sejam de ordem um com relação ao composto aromático e de ordem um com relação ao cloreto de alquila, e que o grupo –OH seja um orientador orto/para dirigente, julgue o item subsequente.
O AlCl3 atua como um ácido de Lewis em reações de
alquilação de Friedel-Crafts.
Considerando, além das informações do texto e da tabela acima, que as alquilações de Friedel-Crafts sejam de ordem um com relação ao composto aromático e de ordem um com relação ao cloreto de alquila, e que o grupo –OH seja um orientador orto/para dirigente, julgue o item subsequente.
O AlCl3 atua como um ácido de Lewis em reações de
alquilação de Friedel-Crafts.

A figura acima ilustra a alquilação de Friedel-Crafts, uma reação de substituição eletrolítica que ocorre entre um anel aromático e um cloreto de alquila. O AlCl3 é o catalisador mais usualmente empregado nesse tipo de reação. Conforme mostrado na reação a seguir, o AlCl3 liga-se ao cloro do cloreto de alquila e libera um carbocátion, que será o responsável pelo ataque eletrofílico ao anel aromático.

Na coluna da direita abaixo, estão listados compostos inorgânicos; na da esquerda, sua classificação.
Associe adequadamente a coluna da esquerda à da direita.
( ) Oxiácido forte
( ) Hidrácido fraco
( ) Base forte
( ) Base fraca
1. Óxido de zinco
2. Hidróxido de alumínio
3. Ácido cianídrico
4. Hidróxido de potássio
5. Ácido sulfúrico
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
Na coluna da direita abaixo, estão listados compostos inorgânicos; na da esquerda, sua classificação. Associe adequadamente a coluna da esquerda à da direita.
( ) Oxiácido forte
( ) Hidrácido fraco
( ) Base forte
( ) Base fraca
1. Óxido de zinco
2. Hidróxido de alumínio
3. Ácido cianídrico
4. Hidróxido de potássio
5. Ácido sulfúrico
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
Considere a reação abaixo.

Assinale a alternativa que preenche corretamente as lacunas do enunciado abaixo, na ordem em
que aparecem.
O composto BF3 apresenta uma geometria ........ e atua como ........ ao reagir com água.
Considere a reação abaixo.

Assinale a alternativa que preenche corretamente as lacunas do enunciado abaixo, na ordem em que aparecem.
O composto BF3 apresenta uma geometria ........ e atua como ........ ao reagir com água.
A contaminação de ecossistemas em função do crescimento populacional e da industrialização tem sido cada vez
maior ao longo dos anos, mesmo com o advento de tecnologias voltadas à descontaminação ambiental. Um dos
efeitos deletérios ao ambiente é a elevada acidez da chuva e de solos. A figura a seguir mostra o efeito que a
acidez do solo causa na velocidade de lixiviação de íons Cd2+.

Dados: Kps para Cd(OH)2(s) = 2,5 x 10−14
Quanto maior a velocidade de lixiviação, maior o transporte de Cd2+ para os lagos por meio da corrente superficial
ou subsuperficial, transferido para os aquíferos ou absorvido pela vegetação, com efeitos tóxicos.
Com base na figura e nos conhecimentos sobre solubilidade de metais e equilíbrio químico, é correto afirmar que
a lixiviação de cádmio
A contaminação de ecossistemas em função do crescimento populacional e da industrialização tem sido cada vez maior ao longo dos anos, mesmo com o advento de tecnologias voltadas à descontaminação ambiental. Um dos efeitos deletérios ao ambiente é a elevada acidez da chuva e de solos. A figura a seguir mostra o efeito que a acidez do solo causa na velocidade de lixiviação de íons Cd2+.

Dados: Kps para Cd(OH)2(s) = 2,5 x 10−14
Quanto maior a velocidade de lixiviação, maior o transporte de Cd2+ para os lagos por meio da corrente superficial ou subsuperficial, transferido para os aquíferos ou absorvido pela vegetação, com efeitos tóxicos.
Com base na figura e nos conhecimentos sobre solubilidade de metais e equilíbrio químico, é correto afirmar que
a lixiviação de cádmio
Leia o texto a seguir.
Diferentes métodos são utilizados por profissionais da área
de Ciência Forense para determinar a quanto tempo o
indivíduo veio a óbito. Pesquisadores brasileiros reportaram
que existe uma relação linear entre a concentração
de Fe2+ no corpo vítreo do olho com o intervalo
pós-morte. Este método é baseado em uma reação de
Fe2+ com orto-fenantrolina como agente cromogênico
realizada em um dispositivo de papel, cujo produto da
reação apresenta coloração alaranjada. Desta forma,
quanto maior o tempo de intervalo pós-morte maior a intensidade
de coloração do produto.
(Adaptado de: GARCIA, P.T.; GABRIEL, E.F.M.; PESSÔA, G.S.; SANTOS
JUNIOR, J.C.; MOLLO FILHO, P. C.; GUIDUGLI, R.B.F.; HÖEHR,
N.F.; ARRUDA, M.A.Z.; COLTRO, W.K.T, Analytica Chimica Acta, v.
974, n.29, p.69-74, 2017).
A equação química da reação de Fe2+ com orto-fenantrolina
é apresentada na figura seguir.

Considerando os conceitos, as definições de ácido
e base e a reação química apresentada, assinale a
alternativa correta.

Tradicionalmente, dividem-se os compostos inorgânicos em quatro classes, por apresentarem
características semelhantes em termos de reatividade e características químicas.
Sobre esse tema, analise as proposições.
I. Óxidos são compostos binários que têm dois elementos (iônicos ou moleculares).
Possuem oxigênio na sua composição, sendo ele o elemento mais eletronegativo.
II. Ácidos, segundo Arrhenius, são substâncias que, em solução aquosa, geram o íon H3O+
.
III. CO2 é classificado como um óxido básico, que reage com a água, tornando o meio ácido,
devido à produção de ácido carbônico (H2CO3).
IV. A maneira mais simples de se obter um sal é por meio de uma reação de neutralização
entre uma base e a água.
V. Em comparação ao ácido clorídrico, o ácido acético é um ácido classificado como forte,
pois se ioniza completamente em água.
VI. Sais são péssimos condutores de eletricidade em estado sólido, mas quando dissolvidos
em água formam íons, o que possibilita então a condução de eletricidade.
Assinale a alternativa correta.
Tradicionalmente, dividem-se os compostos inorgânicos em quatro classes, por apresentarem características semelhantes em termos de reatividade e características químicas. Sobre esse tema, analise as proposições.
I. Óxidos são compostos binários que têm dois elementos (iônicos ou moleculares). Possuem oxigênio na sua composição, sendo ele o elemento mais eletronegativo.
II. Ácidos, segundo Arrhenius, são substâncias que, em solução aquosa, geram o íon H3O+ .
III. CO2 é classificado como um óxido básico, que reage com a água, tornando o meio ácido, devido à produção de ácido carbônico (H2CO3).
IV. A maneira mais simples de se obter um sal é por meio de uma reação de neutralização entre uma base e a água.
V. Em comparação ao ácido clorídrico, o ácido acético é um ácido classificado como forte, pois se ioniza completamente em água.
VI. Sais são péssimos condutores de eletricidade em estado sólido, mas quando dissolvidos em água formam íons, o que possibilita então a condução de eletricidade.
Assinale a alternativa correta.