Questõessobre Sistemas Homogêneos: Constantes: Kc e Kp. Deslocamento do Equilíbrio: Fatores.
Br2(g) + H2(g) ⇌ 2HBr(g)
Um dado sistema em que inicialmente existem apenas
reagentes pode convergir para um estado em que há
reagentes e produtos coexistindo com concentrações
constantes ao longo do tempo. Essas concentrações não se
alteram em razão de as reações direta e inversa se
processarem com velocidades iguais, o que caracteriza um
estado de equilíbrio dinâmico.
De acordo com essas informações e considerando o sistema,
representado pela equação química, formado inicialmente pela
mistura de 1,0mol de Br2(g) com 1,0mol de H2(g), contida em
um recipiente de 10,0L, a determinada temperatura, ao atingir
o estado de equilíbrio, apresentou 0,20mol de HBr, é correto
afirmar:
A fenolftaleína atua como um indicador ácido-base por
ser um ácido fraco, que em solução alcóolica, apresenta a
cor das moléculas não-dissociadas, HInd, diferente da cor
dos respectivos íons, Ind–.
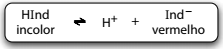
A leitura da mensagem no experimento descrito é possível
porque a presença de íons OH– na solução de fenolftaleína
promove deslocamento do equilíbrio para a
A fenolftaleína atua como um indicador ácido-base por ser um ácido fraco, que em solução alcóolica, apresenta a cor das moléculas não-dissociadas, HInd, diferente da cor dos respectivos íons, Ind–.

A leitura da mensagem no experimento descrito é possível
porque a presença de íons OH– na solução de fenolftaleína
promove deslocamento do equilíbrio para a
Experiência – Escrever uma mensagem secreta no laboratório
Materiais e Reagentes Necessários
✓ Folha de papel
✓ Pincel fino
✓ Difusor
✓ Solução de fenolftaleína
✓ Solução de hidróxido de sódio 0,1 mol/L ou solução saturada de hidróxido de cálcio
Procedimento Experimental
Utilizando uma solução incolor de fenolftaleína, escreva com um pincel fino uma mensagem numa folha de papel.
A mensagem permanecerá invisível.
Para revelar essa mensagem, borrife a folha de papel com uma solução de hidróxido de sódio ou de cálcio, com o auxílio de um difusor.
A mensagem aparecerá magicamente com a cor vermelha.
Explicação
fenolftaleína é um indicador que fica vermelho na presença de soluções básicas, nesse caso, uma solução de hidróxido de sódio ou de cálcio.
A constante de equilíbrio para a reação II, a 298K, é 1,05.10–5.

Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:
Uma diminuição de pressão favorece a formação de CO2
na reação I.

Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:
Em 1912, o químico alemão Fritz Haber desenvolveu um processo para sintetizar a amônia
diretamente a partir de hidrogênio e nitrogênio. O processo também é conhecido como
Haber-Bosch, para homenagear o engenheiro Karl Bosch, que desenvolveu o equipamento
para a produção industrial da amônia. A reação base do processo consiste no equilíbrio
químico a seguir:
N2(g) + 3 H2(g) ⇋ 2 NH3(g) ∆H < 0
Assinale a alternativa a seguir correspondente à ação que aumentaria a concentração da
amônia:
N2O4(g) ⇋ 2NO2(g) ΔHo
= 58,0 kJ
De acordo com o princípio de Le Chatelier, se um sistema em
equilíbrio é perturbado por uma variação de temperatura,
pressão ou concentração de seus componentes, o sistema
deslocará sua posição de equilíbrio de tal forma que neutralize
o efeito do distúrbio.
A partir da aplicação do princípio de Le Chatelier ao sistema
em equilíbrio químico, representado pela equação termoquímica,
é correto afirmar:
Considere o equilíbrio químico a seguir:
X + Y ⇌ 2 Z
Sabendo que todas as substâncias acima estão no estado gasoso, assinale a alternativa
correta:
Considere o equilíbrio químico a seguir:
X + Y ⇌ 2 Z
Sabendo que todas as substâncias acima estão no estado gasoso, assinale a alternativa correta:
Um dos mais importantes processos industriais é
a fixação do nitrogênio através de sua transformação em
amônia, podendo ser representado pela equação a seguir:
N2
(g) + 3H2
(g)  2NH3(g) ΔH = - 92kJ.mol-1
2NH3(g) ΔH = - 92kJ.mol-1
Em relação a esse processo, haverá maior concentração do
produto quando ocorrer
Um dos mais importantes processos industriais é a fixação do nitrogênio através de sua transformação em amônia, podendo ser representado pela equação a seguir:
N2
(g) + 3H2
(g)  2NH3(g) ΔH = - 92kJ.mol-1
2NH3(g) ΔH = - 92kJ.mol-1
Em relação a esse processo, haverá maior concentração do produto quando ocorrer
Considere o equilíbrio químico: A  2B + C e as concentrações iniciais seguintes:
2B + C e as concentrações iniciais seguintes:

Um experimento, realizado a 25 °C, mostrou que para 1 litro de reagente o equilíbrio foi atingido quando 0,5 moles
do reagente foram consumidos. Assinale o valor da constante de equilíbrio da reação.
Considere o equilíbrio químico: A  2B + C e as concentrações iniciais seguintes:
2B + C e as concentrações iniciais seguintes:

Um experimento, realizado a 25 °C, mostrou que para 1 litro de reagente o equilíbrio foi atingido quando 0,5 moles
do reagente foram consumidos. Assinale o valor da constante de equilíbrio da reação.
A reação A 2B + C apresenta, numa dada temperatura, constante de equilíbrio K = 1. A tabela abaixo
representa, sob essa mesma temperatura, concentrações de A, B e C presentes numa mistura de A, B e C.
2B + C apresenta, numa dada temperatura, constante de equilíbrio K = 1. A tabela abaixo
representa, sob essa mesma temperatura, concentrações de A, B e C presentes numa mistura de A, B e C.

É CORRETO afirmar que está em equilíbrio a mistura:
 2B + C apresenta, numa dada temperatura, constante de equilíbrio K = 1. A tabela abaixo
representa, sob essa mesma temperatura, concentrações de A, B e C presentes numa mistura de A, B e C.
2B + C apresenta, numa dada temperatura, constante de equilíbrio K = 1. A tabela abaixo
representa, sob essa mesma temperatura, concentrações de A, B e C presentes numa mistura de A, B e C. 
O Princípio de Le Chatelier diz que “Quando uma perturbação
exterior é aplicada a um sistema em equilíbrio dinâmico, ele
tende a ajustar para reduzir ao mínimo o efeito da
perturbação." Considere uma mistura de quatro gases, NH3,
O2, NO e H2O, colocada em um reator, atingindo o equilíbrio
conforme a reação
4NH3 (g) + 5O2 (g) 4NO (g) + 6H2O (g)
4NO (g) + 6H2O (g)  H < 0
H < 0
Qual das afirmações a seguir é INCORRETA?
 4NO (g) + 6H2O (g)
4NO (g) + 6H2O (g)  H < 0
H < 0 O pH plasmático deve ser mantido na faixa de 7,35 -
7,45. Variações do pH afetam a estrutura das proteínas
e, consequentemente, os processos bioquímicos. Nosso
organismo produz várias substâncias capazes de alterar
o pH do plasma como, por exemplo, o ácido láctico e
os corpos cetônicos. A manutenção do pH ideal é feita
graças à existência: dos sistemas tampão, do centro
respiratório e do sistema renal. O principal sistema
tampão presente no plasma é constituído por ácido
carbônico/hidrogenocarbonato. Esse sistema envolve
três equilíbrios, os quais estão representados abaixo.
Observe os equilíbrios e avalie as afirmativas.
(1) CO2(g) ⇋ CO2(aq)(2) CO2(aq) + H2O (l) ⇋ H2CO3(aq)(3) H2CO3(aq) + H2O (l) ⇋ HCO3-(aq)+ H3O+ (aq)
I. O equilíbrio representado na equação 3 mostra o
ácido carbônico, que é um ácido fraco, e o HCO3- sua
base conjugada.
II. A adição de H3O+, proveniente de uma substância
ácida, reage com os íons hidrogenocarbonato
deslocando o equilíbrio (equação 3) para a esquerda.
III. A solução tampão impede a variação de pH somente
quando substâncias ácidas são adicionadas, não sendo
possível a manutenção do pH frente à adição de
substâncias básicas.
IV. A solução tampão mantém o pH relativamente
constante, independentemente da quantidade de
H3O+ adicionada .
É CORRETO afirmar que
Quando aldeídos, como o formaldeído, são dissolvidos em água, há formação de hidratos (conforme representação
na equação abaixo). Essa reação é catalisada tanto por ácidos quanto por bases.

Sobre a reação, considerando temperatura constante, a adição de um(a)
Quando aldeídos, como o formaldeído, são dissolvidos em água, há formação de hidratos (conforme representação na equação abaixo). Essa reação é catalisada tanto por ácidos quanto por bases.

Sobre a reação, considerando temperatura constante, a adição de um(a)
Considere uma solução aquosa na qual se tem o equilíbrio abaixo.
NH4OH(aq)  NH4+(aq) + OH-
(aq)
NH4+(aq) + OH-
(aq)
Adiciona-se 1 mL de solução aquosa de cloreto de amônio (NH4Cl),com concentração igual a 1 mol L-1
,
a 100 mL da solução aquosa de concentração igual a 0,1 mol L
-1 de hidróxido de amônio (NH4OH). Após a
adição da solução salina, o pH da solução resultante, em relação ao pH da solução original de NH4OH, se torna
 NH4+(aq) + OH-
(aq)
NH4+(aq) + OH-
(aq)
Assinale o equilíbrio que será afetado por uma mudança de pressão.
Considere o processo de equilíbrio de formação do óxido de carbono:
C(s) + 1/2 O2(g) ⇄ CO(g) ∆H = -110,5 kJ mol-1
É CORRETO afirmar que:
Considere o processo de equilíbrio de formação do óxido de carbono:
C(s) + 1/2 O2(g) ⇄ CO(g) ∆H = -110,5 kJ mol-1
É CORRETO afirmar que:
Considerando que a obtenção do vinagre é feita
por fermentação, assinale a alternativa que mostra o que
deve ocorrer no meio de reação para que a indústria
obtenha maior quantidade de vinagre.
“O vinagre é uma solução diluída de ácido acético, elaborada de dois processos consecutivos: a fermentação alcoólica, representada pela conversão de açúcar em etanol por leveduras, e a fermentação acética, que corresponde à transformação do álcool em ácido acético por determinadas bactérias. [...]. O ácido acético é um ácido orgânico que pertence ao grupo dos ácidos carboxílicos e apresenta alta gama de utilizações. Uma de suas principais ações é como agente antimicrobiano. Em uma análise bacteriológica in vitro verificou-se que o ácido acético a 2,0 e 5,0% é eficaz sobre Pseudomonas aeruginosa e Escherichia coli. Posteriormente, estudos in vivo também demonstraram a atividade antibacteriana desse ácido. Diante disso, o vinagre pode ser utilizado como agente antimicrobiano devido a sua concentração de ácido acético.”
Bromatologia em Saúde, UFRJ. “Vinagre de maçã: sinônimo de saúde
e beleza”, 2011. Disponível em: http://bromatopesquisasufrj.blogspot.com.br/2011/12/vinagre-de-maca-sinonimo-de-saude-e.html. Acesso em nov. 2017. (Adaptado)
A 400º C, uma mistura gasosa de H2
, I2
e HI em
equilíbrio contém 0,0031 mols de H2
, 0,0031 mols de I2
e
0,0029 mols de HI por litro. Ao ser alcançado o equilíbrio,
verifica-se que o valor da constante de equilíbrio em termos
de concentração (Kc
) é igual a 59,4. A reação que se
processa pode ser escrita da seguinte maneira:
H2(g) + I2(g)  2HI(g)
2HI(g)
Que alterações farão variar a constante de equilíbrio da
reação entre o H2(g) e o I2(g)?
I adição de um catalisador
II aumento da pressão (temperatura constante)
III aumento da concentração dos reagentes
IV aumento da temperatura
V aumento da concentração dos produtos
 2HI(g)
2HI(g)
A partir dessas informações, e considerando que uma solução saturada de CaCO3 apresente comportamento ideal e que a constante de solubilidade do CaCO3 seja igual a 8,1 × 10-9 , julgue o item que se segue.
O consumo dos íons carbonato em meio ácido aumenta a
solubilidade do CaCO3 e do Na2CO3, o que acelera a
degradação de monumentos, conforme mencionado no texto.
A partir dessas informações, e considerando que uma solução saturada de CaCO3 apresente comportamento ideal e que a constante de solubilidade do CaCO3 seja igual a 8,1 × 10-9 , julgue o item que se segue.
O consumo dos íons carbonato em meio ácido aumenta a
solubilidade do CaCO3 e do Na2CO3, o que acelera a
degradação de monumentos, conforme mencionado no texto.
A chuva ácida intensifica a degradação de monumentos históricos. A maioria desses monumentos é feita de mármore, que é o carbonato de cálcio na forma cristalina, CaCO3(s), e de pedra-sabão, que tem o carbonato de sódio, Na2CO3(s), como um de seus constituintes. Esses sais, CaCO3(s) e Na2CO3(s), são pouco solúveis em água, mas, em meio ácido, o íon carbonato é convertido em H2CO3, o qual, por sua vez, decompõe-se em água e CO2, conforme a equação de equilíbrio apresentada abaixo.
