Quatro fatores afetam o equilíbrio químico de um sistema, mas apenas um deles modifica o valor da constante. Esse fator é o(a)

Gabarito comentado
Esta questão aborda conceitos relacionados ao equilíbrio químico.
De acordo com os princípios de Le Chatelier, quando há uma perturbação
no sistema, o equilíbrio se deslocará no sentido de minimizar essa
perturbação e restabelecer um novo equilíbrio químico. Quatro fatores afetam o
equilíbrio químico de um sistema, a temperatura, a pressão, a
concentração e o volume.
Uma reação reversível genérica pode ser representada por:
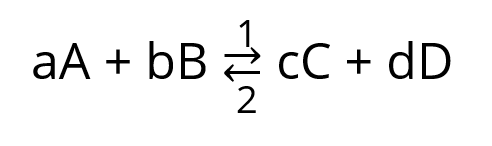
As expressões de velocidades para as reações direta e inversa são:
Direta: v1 = k1[A]a[B]b
Inversa: v2 = k2[C]c[D]d
No equilíbrio temos v1 = v2, logo:
k1[A]a[B]b = k2[C]c[D]d ou k1/k2 = {[A]a[B]b}/{[C]c[D]d}
Assim, a constante de equilíbrio em termos de concentração (KC) é dada pela relação k1/k2:
KC = {[A]a[B]b}/{[C]c[D]d}
Com base no exposto, analisemos como esses fatores afetam o equilíbrio para determinarmos qual modifica o valor da constante:
• Temperatura:
O equilíbrio é deslocado no sentido endotérmico (∆H > 0) da reação
com o aumento da temperatura e deslocado no sentido exotérmico (∆H < 0) com
a diminuição da temperatura.
Considerando uma reação hipotética:
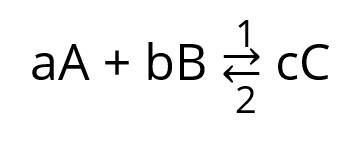
Supondo que ela seja endotérmica no sentido 1 e exotérmica no sentido 2. Sua constante de equilíbrio é dada por:
KC = [C]c/{[A]a[B]b}
Caso haja um aumento na temperatura do sistema, o equilíbrio é deslocado
para o sentido endotérmico (1). Assim, ocorre um aumento na concentração de C,
o que indica que o valor de KC também aumenta. Logo, variações na
temperatura do sistema deslocam o equilíbrio e modificam o valor da constante.
• Concentração:
Quando há uma variação na concentração de reagentes ou produtos, o equilíbrio é deslocado no sentido do consumo da substância que teve sua concentração aumentada. Variações na concentração das substâncias não afetam a constante de equilíbrio. Por exemplo, quando há a adição de um reagente o equilíbrio é deslocado no sentido de seu consumo (formação dos produtos), o que aumenta a concentração do produto até que o equilíbrio seja restabelecido. Como há a compensação nos valores das outras concentrações, no equilíbrio, a constante não é alterada.
• Pressão/Volume:
A
pressão e o volume são inversamente proporcionais (quanto maior a pressão menor
o volume). Sendo assim, o aumento da pressão, por exemplo, provoca contração no
volume, o que faz com que o equilíbrio seja deslocado no sentido do menor
volume. Já a diminuição da pressão provoca expansão do volume e o equilíbrio é
deslocado no sentido de maior volume. Assim como o que foi explicado para a
concentração, quando há alterações na pressão, o equilíbrio é deslocado para
minimizar essa perturbação. Essa compensação faz com que o valor da constante
não seja alterado no equilíbrio.
Portanto, apenas a temperatura modifica o valor da constante do equilíbrio.
Gabarito da Professora: Letra A.






