Questão d9f28910-66
Prova:UNIFESP 2006
Disciplina:Química
Assunto:Sistemas Gasosos - Lei, Teoria Cinética, Equação e Mistura dos Gases. Princípio de Avogadro., Transformações Químicas
A figura representa um experimento de coleta de 0,16 g de gás oxigênio em um tubo de ensaio inicialmente preenchido com água destilada a 27 °C.
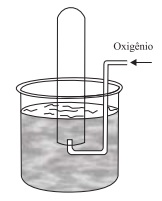
Quando o nível da água dentro do tubo de ensaio é o mesmo que o nível de fora, a pressão no interior do tubo é de 0,86 atm. Dadas a pressão de vapor (H2O) a 27 °C = 0,040 atm e R = 0,082 atm·L·K–1 ·mol –1 , o volume de gás, em mL, dentro do tubo de ensaio é igual a
A figura representa um experimento de coleta de 0,16 g de gás oxigênio em um tubo de ensaio inicialmente preenchido com água destilada a 27 °C.

Quando o nível da água dentro do tubo de ensaio é o mesmo que o nível de fora, a pressão no interior do tubo é de 0,86 atm. Dadas a pressão de vapor (H2O) a 27 °C = 0,040 atm e R = 0,082 atm·L·K–1 ·mol –1 , o volume de gás, em mL, dentro do tubo de ensaio é igual a

Quando o nível da água dentro do tubo de ensaio é o mesmo que o nível de fora, a pressão no interior do tubo é de 0,86 atm. Dadas a pressão de vapor (H2O) a 27 °C = 0,040 atm e R = 0,082 atm·L·K–1 ·mol –1 , o volume de gás, em mL, dentro do tubo de ensaio é igual a
A
30.
B
140.
C
150.
D
280.
E
300.
Gabarito comentado
Thaís GuimarãesMestra em Química (UERJ) e Doutoranda em Química (UERJ)
Pela Lei de Dalton, temos que:
PT = PO2 + PH2O,
Logo, PO2 = PT – PH2O
PO2 = 0,86 – 0,04 = 0,82 atm.
Então, PO2VT = NO2RT
0,82VT = 0,16 . 0,082. 300 / 32
VT = 0,15 L ou 150 Ml
Opção correta C.






