Questão c2f37b7d-4b
Prova:UFRN 2008
Disciplina:Química
Assunto:Equilíbrio Químico, Sistemas Homogêneos: Constantes: Kc e Kp. Deslocamento do Equilíbrio: Fatores.
O gráfico abaixo representa a modificação que acontece nas concentrações dos reagentes e produto, após uma perturbação do equilíbrio no tempo t1
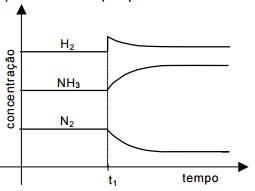
De acordo com o gráfico, essa perturbação poderia ser causada por
O gráfico abaixo representa a modificação que acontece nas concentrações dos reagentes e produto, após uma perturbação do equilíbrio no tempo t1

De acordo com o gráfico, essa perturbação poderia ser causada por
As questões de 01 a 05 referem-se ao texto abaixo.

As questões de 01 a 05 referem-se ao texto abaixo.


A
aumento da pressão total.
B
adição de NH3(g).
C
aumento da temperatura.
D
adição de H2(g)
Gabarito comentado
Thaís GuimarãesMestra em Química (UERJ) e Doutoranda em Química (UERJ)
De acordo com a reação apresentada N2 + 3H2 → 2NH3 e o princípio de Le Chatelier, tem-se que:
O aumento da pressão promove o deslocamento do equilíbrio para o lado de menor volume, dessa forma o equilíbrio seria deslocado para o lado dos produtos aumentando a concentração de amônia. Contudo, percebe-se que existe um momento em que a concentração de hidrogênio aumenta, e sendo ele um reagente, não sofreria essa modificação causada pelo aumento da pressão.
A adição de NH3 deslocaria o equilíbrio para o lado dos reagentes, fazendo com que a concentração de hidrogênio e nitrogênio aumentassem. Contudo isso não é observado no gráfico.
O aumento da temperatura desloca o equilíbrio para o sentido endotérmico da reação. Levando em consideração que o sentido direto da reação é exotérmico, o sentido deslocado pelo aumento da temperatura é o lado dos reagentes.
Por fim, ao adicionar H2 o equilíbrio automaticamente é deslocado para a formação de amônia, sentido dos produtos, sendo portanto, essa opção a correta.
O aumento da pressão promove o deslocamento do equilíbrio para o lado de menor volume, dessa forma o equilíbrio seria deslocado para o lado dos produtos aumentando a concentração de amônia. Contudo, percebe-se que existe um momento em que a concentração de hidrogênio aumenta, e sendo ele um reagente, não sofreria essa modificação causada pelo aumento da pressão.
A adição de NH3 deslocaria o equilíbrio para o lado dos reagentes, fazendo com que a concentração de hidrogênio e nitrogênio aumentassem. Contudo isso não é observado no gráfico.
O aumento da temperatura desloca o equilíbrio para o sentido endotérmico da reação. Levando em consideração que o sentido direto da reação é exotérmico, o sentido deslocado pelo aumento da temperatura é o lado dos reagentes.
Por fim, ao adicionar H2 o equilíbrio automaticamente é deslocado para a formação de amônia, sentido dos produtos, sendo portanto, essa opção a correta.






