Questão 884f5014-31
Prova:PUC - PR 2015
Disciplina:Química
Assunto:Equilíbrio Químico, Sistemas Homogêneos: Constantes: Kc e Kp. Deslocamento do Equilíbrio: Fatores.
O Princípio de Le Chatelier infere que quando uma perturbação é imposta a um sistema químico em equilíbrio, este irá
se deslocar de forma a minimizar tal perturbação.
Disponível em: <brasilescola.com/exercicios-quimica/exercicios-sobre-principio-le-chatelier.htm>
O gráfico apresentado a seguir indica situações referentes à perturbação do equilíbrio químico indicado pela equação
H2(g) + I2(g) 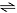
2 HI(g)

A partir da equação química apresentada e da observação do gráfico, considerando também que a reação é endotérmica
em favor da formação do ácido iodídrico, a dinâmica do equilíbrio favorecerá
O Princípio de Le Chatelier infere que quando uma perturbação é imposta a um sistema químico em equilíbrio, este irá se deslocar de forma a minimizar tal perturbação.
Disponível em: <brasilescola.com/exercicios-quimica/exercicios-sobre-principio-le-chatelier.htm>
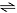

A
a formação de iodo quando da adição de gás hidrogênio.
B
o consumo de iodo quando da adição de gás hidrogênio.
C
a diminuição na quantidade de ácido iodídrico quando do aumento da temperatura.
D
o aumento na quantidade das substâncias simples quando ocorrer elevação da pressão total do sistema.
E
formação de gás hidrogênio na reação direta a partir de t1, em virtude da adição de ácido iodídrico.






