O flúor é um elemento natural encontrado em quase toda a água e em muitos solos. É considerado como essencial devido ao seu efeito benéfico no esmalte dental, conferindo resistência máxima às cáries. É prontamente absorvido pelo trato intestinal, pulmões e pele. Sua eliminação se dá pelos rins e, em pequenas quantidades, pelas glândulas sudoríparas e tubo gastrointestinal. Com relação ao flúor, assinale o correto.
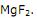
Gabarito comentado
Flúor
é um elemento químico, símbolo F, de número atômico 9 (9 prótons e 9 elétrons)
de massa atómica 19 u, situado no grupo dos halogênios (grupo 17 ou VIIA) da
tabela periódica dos elementos. Em sua forma biatômica (F2) e em CNTP, é um gás
de coloração amarelo-pálido. É o mais eletronegativo e reativo de todos os
elementos. Em sua forma ionizada (F–) é extremamente perigoso, podendo
ocasionar graves queimaduras químicas se em contato com tecidos vivos.
Na
CNTP, o flúor é um gás corrosivo de coloração amarelo-pálido, fortemente
oxidante. É o elemento mais eletronegativo e o mais reativo dos ametais e forma
compostos com praticamente todos os demais elementos, incluindo os gases nobres
xenônio e radônio. Inclusive em ausência de luz e baixas temperaturas reage
explosivamente com o hidrogênio. Jatos de flúor no estado gasoso atacam o
vidro, metais, água e outras substâncias, que reagem formando uma chama
brilhante. O flúor sempre se encontra combinado na natureza e tem afinidade por
muitos elementos, especialmente o silício, não podendo ser guardado em
recipientes de vidro. Em solução aquosa de seus sais, o flúor apresenta-se
normalmente na forma de íons fluoretos, F–. Outras formas são complexos de
flúor como o [FeF4]–, ou o H2F+. Os fluoretos são compostos nas quais os íons
fluoretos estão ligados a algum resto químico de carga positiva.
O
flúor não é considerado um elemento mineral essencial para o ser humano1 .
Pequenas quantidades de flúor podem beneficiar o fortalecimento ósseo, mas sua
falta é um problema apenas na formulação de dietas artificiais.
Opção correta B.






