
A chuva ácida é a precipitação com a presença de ácido
sulfúrico, ácido nítrico e nitroso, resultantes de reações
químicas que ocorrem na atmosfera. Todas as chuvas são
ácidas, mesmo em ambientes sem poluição conforme mostra a
figura apresentada. (A CHUVA, 2019).
A chuva ácida é a denominação de um fenômeno típico que
ocorre devido, principalmente,


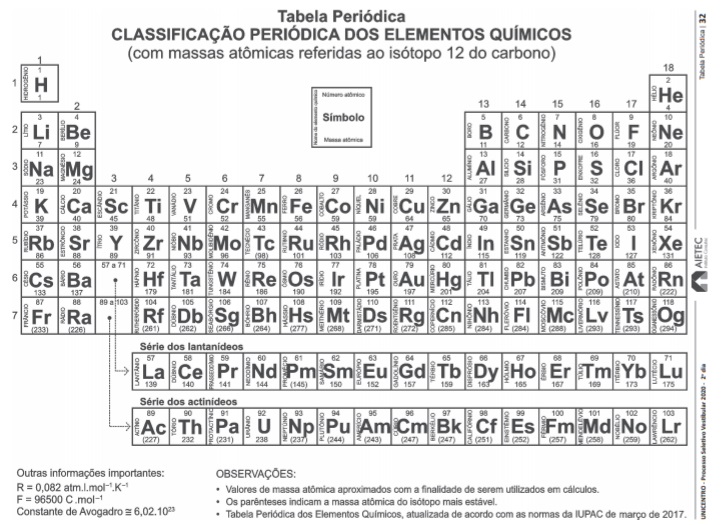


 .
.
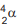 ou beta,
ou beta, 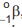 , e se
transformar em outro átomo, que, por sua vez, se desintegra
e se transforma em um terceiro e, assim, sucessivamente, até
a sequência chegar a um átomo estável. A sequência de
átomos é denominada série radioativa natural quando ocorre
de forma espontânea, na natureza com elementos radioativos.
A série do urânio 238, após decaimentes radioativos chega ao
chumbo 206,
, e se
transformar em outro átomo, que, por sua vez, se desintegra
e se transforma em um terceiro e, assim, sucessivamente, até
a sequência chegar a um átomo estável. A sequência de
átomos é denominada série radioativa natural quando ocorre
de forma espontânea, na natureza com elementos radioativos.
A série do urânio 238, após decaimentes radioativos chega ao
chumbo 206, 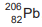 , átomo estável, como mostra a equação
nuclear global.
, átomo estável, como mostra a equação
nuclear global. ao emitir uma partícula alfa, se
transforma em polônio 218,
ao emitir uma partícula alfa, se
transforma em polônio 218,  .
. , ao emitir uma partícula beta, se
transforma em polônio 210,
, ao emitir uma partícula beta, se
transforma em polônio 210,  .
.


