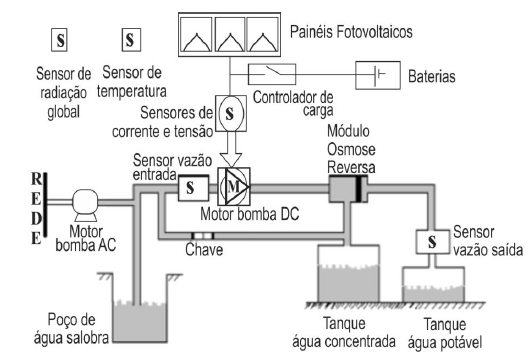
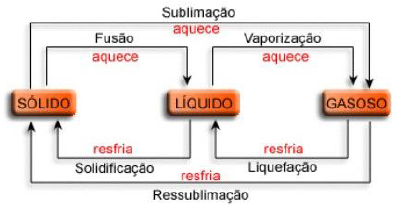
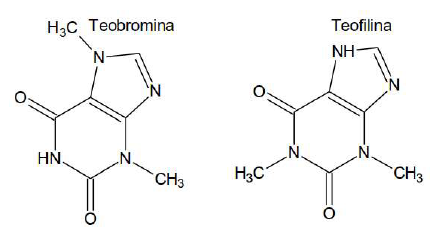
O texto faz referência às conclusões de Bohr ao explicar as dificuldades teóricas do modelo atômico
rutherfordiano.
1. Que a energia radiada não é emitida (ou absorvida) da maneira contínua admitida pela
eletrodinâmica clássica, mas apenas durante a passagem dos sistemas de um estado
"estacionário" para outro diferente.
2. Que o equilíbrio dinâmico dos sistemas nos estados estacionários é governado pelas
leis da mecânica clássica, não se verificando estas leis nas transições dos sistemas entre
diferentes estados estacionários.
3. Que é homogênea a radiação emitida durante a transição de um sistema de um estado
estacionário para outro, e que a relação entre a frequência n e a quantidade total de
energia emitida é dada por E = hn, sendo h a constante de Planck.
4. Que os diferentes estados estacionários de um sistema simples constituído por um
elétron que gira em volta de um núcleo positivo são determinados pela condição de ser
igual a um múltiplo inteiro de h/2 a razão entre a energia total emitida durante a formação
da configuração e a frequência de revolução do elétron. Admitindo que a órbita do elétron
é circular, esta hipótese equivale a supor que o momento angular do elétron em torno do
núcleo é igual a um múltiplo inteiro de h/2p.
5. Que o estado "permanente" de um sistema atômico - isto é, o estado no qual a energia
emitida é máxima - é determinado pela condição de ser igual a h/2p o momento angular
de cada elétron em torno do centro da sua órbita.
Disponível em: <https://www.if.ufrgs.br/tex/fis142/fismod/mod06/m_s04.html> Acesso em: 15 abr. 2017.
O problema que motivou Bohr a propor suas explicações e, consequentemente, seu modelo, baseou-se
em qual das seguintes considerações?