d87618a8-62
UFMG 2007 - Química - Soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais., Sistemas Gasosos - Lei, Teoria Cinética, Equação e Mistura dos Gases. Princípio de Avogadro., Transformações Químicas, Soluções e Substâncias Inorgânicas
À temperatura de 25 °C e pressão de 1 atm, as substâncias amônia,  , dióxido de carbono,
, dióxido de carbono, 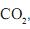 , e hélio, He, são gases.
, e hélio, He, são gases.
Considerando-se as características de cada uma dessas substâncias, assinale a alternativa em que a apresentação dos três gases, segundo a ordem crescente de sua solubilidade em água líquida, está CORRETA.
À temperatura de 25 °C e pressão de 1 atm, as substâncias amônia,  , dióxido de carbono,
, dióxido de carbono, 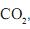 , e hélio, He, são gases.
, e hélio, He, são gases.
Considerando-se as características de cada uma dessas substâncias, assinale a alternativa em que a apresentação dos três gases, segundo a ordem crescente de sua solubilidade em água líquida, está CORRETA.
 , dióxido de carbono,
, dióxido de carbono, 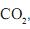 , e hélio, He, são gases.
, e hélio, He, são gases.Considerando-se as características de cada uma dessas substâncias, assinale a alternativa em que a apresentação dos três gases, segundo a ordem crescente de sua solubilidade em água líquida, está CORRETA.
A

B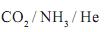
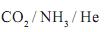
C

D

 .
. 
 diminui a energia cinética média das moléculas de água.
diminui a energia cinética média das moléculas de água. é maior que zero.
é maior que zero. e ácido sulfúrico,
e ácido sulfúrico,  . No interior do extintor, essas duas substâncias fcam separadas, uma da outra. Para ser usado, o extintor deve ser virado de cabeça para baixo, a fm de possibilitar a mistura dos compostos, que, então, reagem entre si.
. No interior do extintor, essas duas substâncias fcam separadas, uma da outra. Para ser usado, o extintor deve ser virado de cabeça para baixo, a fm de possibilitar a mistura dos compostos, que, então, reagem entre si. 





 é menor com a acidificação do meio.
é menor com a acidificação do meio.
 foram consumidos 20 mL da solução ácida. Pelo uso de ndicadores apropriados, é possível constatar-se que, na reação I, foram consumidos 5 mL dessa solução ácida e, na reação II, os 15 mL restantes.
foram consumidos 20 mL da solução ácida. Pelo uso de ndicadores apropriados, é possível constatar-se que, na reação I, foram consumidos 5 mL dessa solução ácida e, na reação II, os 15 mL restantes.





 ser menor que a de
ser menor que a de  .
. ser menor que a de
ser menor que a de 
 ser maior que a de
ser maior que a de 


 gasoso.
gasoso.