Questõesde CEDERJ sobre Transformações Químicas
O segundo postulado da teoria atômica de Dalton
estabelecia que “átomos de um mesmo elemento químico são idênticos e iguais em peso”. Por mais de um
século essa concepção foi hegemônica, o que levou a
um problema, aparentemente sem solução, relacionado
à determinação das massas atômicas dos elementos
químicos, cujos valores variavam de um experimento
para outro. O surgimento da espectrometria de massas,
no início do Século XX, solucionou o problema com a
grande contribuição de Francis W. Aston, que recebeu o
Prêmio Nobel de Química em 1922. A técnica analítica
consiste em separar íons no estado gasoso, por meio
da relação massa/carga de átomos e moléculas. Tal ferramenta permitiu a determinação precisa das massas
atômicas dos elementos.
O desenvolvimento da espectrometria de massas levou
à confirmação da existência dos
Tem-se dois balões A e B, ligados por um tubo de
comunicação munido de torneira. O balão A contém 3.2 g de
O2
(g) e o balão B está vazio (vácuo). Abrindo-se a torneira de
comunicação, depois de um tempo prolongado, a pressão do
O2
(g) nos balões interligados é igual a 0.41 atm.
Considerando-se desprezível o volume do tubo de comunicação e sabendo-se que o volume do balão A é igual a
4.1 L e que a temperatura foi mantida em 27 ºC durante todo
processo, o volume do balão B corresponde a:
Um laboratório de controle ambiental recebeu para
análise uma amostra de gás sem identificação. Após algumas medidas, foram obtidos os seguintes dados:

Com base nos valores obtidos, entre os gases indicados
nas opções, conclui-se que a amostra era de:
Um laboratório de controle ambiental recebeu para análise uma amostra de gás sem identificação. Após algumas medidas, foram obtidos os seguintes dados:

Com base nos valores obtidos, entre os gases indicados
nas opções, conclui-se que a amostra era de:
O átomo de um elemento químico tem 16 elétrons no
3º nível energético (n = 3). O número atômico desse elemento é:
Dentre os diversos agentes tóxicos, o arsênio é historicamente famoso por se tratar de uma substância muito
utilizada na Idade Média para assassinatos com interesses
políticos. Podemos até dizer que a morte por arsênio foi a
precursora da química forense. Na época, havia uma epidemia desses casos, cuja prevenção era muito difícil, uma
vez que óxido de arsênio, As2O3, é um sólido branco, solúvel, sem cheiro e gosto, sendo dificilmente detectado por
análises químicas convencionais, o que lhe deu o status de
óxido do crime perfeito. Além disso, o óxido de arsênio (III)
é um composto muito utilizado na fabricação de vidros e
inseticidas. Ele é convertido em ácido arsenioso (H3AsO3
)
em contato com água. Um método para se determinar o
teor de arsênio é por meio de oxidação com permanganato
de potássio e ácido sulfúrico, conforme equação não balanceada a seguir:
H3AsO3 + KMnO4 + H2SO4 → H3AsO4 + K2SO4 + MnSO4 + H2O
Sabendo que para 2,000 g de amostra foram gastos
10,00 mL de uma solução de KMnO4 0,05 M, em que ocorre a reação acima completa, em meio de ácido sulfúrico, o
percentual de arsênio na amostra é:
Dentre os diversos agentes tóxicos, o arsênio é historicamente famoso por se tratar de uma substância muito utilizada na Idade Média para assassinatos com interesses políticos. Podemos até dizer que a morte por arsênio foi a precursora da química forense. Na época, havia uma epidemia desses casos, cuja prevenção era muito difícil, uma vez que óxido de arsênio, As2O3, é um sólido branco, solúvel, sem cheiro e gosto, sendo dificilmente detectado por análises químicas convencionais, o que lhe deu o status de óxido do crime perfeito. Além disso, o óxido de arsênio (III) é um composto muito utilizado na fabricação de vidros e inseticidas. Ele é convertido em ácido arsenioso (H3AsO3 ) em contato com água. Um método para se determinar o teor de arsênio é por meio de oxidação com permanganato de potássio e ácido sulfúrico, conforme equação não balanceada a seguir:
H3AsO3 + KMnO4 + H2SO4 → H3AsO4 + K2SO4 + MnSO4 + H2O
Sabendo que para 2,000 g de amostra foram gastos
10,00 mL de uma solução de KMnO4 0,05 M, em que ocorre a reação acima completa, em meio de ácido sulfúrico, o
percentual de arsênio na amostra é:
A partir da reação abaixo o volume aproximado, em metros cúbicos de etileno (d=1.18 kg/m3
),
necessário para preparar 2.0 toneladas de gás mostarda
é:

A partir da reação abaixo o volume aproximado, em metros cúbicos de etileno (d=1.18 kg/m3 ), necessário para preparar 2.0 toneladas de gás mostarda é:

O Halotano, C2HBrClF3
, é um gás não inflamável,
não explosivo, e não irritante que é geralmente usado
como anestésico, por inalação. Suponha que se faça a
mistura de 15.0 g de vapor de Halotano com 23.5 g do
gás oxigênio sendo que a pressão total da mistura seja
igual a 855 mmHg.
Nas condições apresentadas as pressões parciais
do halotano e do oxigênio na mistura serão,
respectivamente:
O Halotano, C2HBrClF3 , é um gás não inflamável, não explosivo, e não irritante que é geralmente usado como anestésico, por inalação. Suponha que se faça a mistura de 15.0 g de vapor de Halotano com 23.5 g do gás oxigênio sendo que a pressão total da mistura seja igual a 855 mmHg.
Nas condições apresentadas as pressões parciais do halotano e do oxigênio na mistura serão, respectivamente:
O sulfeto de níquel (II), NiS, ocorre na natureza
como um mineral relativamente raro, a millerita. Uma de
suas ocorrências é em meteoritos. Para se determinar a
quantia de NiS em uma amostra do mineral, ela é tratada
com ácido nítrico para liberar o níquel.
NiS(s) + 4HNO3(aq) → Ni(NO3)2(aq) + S(s) + 2NO2(g) + 2H2O(l)
A solução aquosa de Ni(NO3)2
é então tratada com
o composto orgânico dimetilglioxima (C4H8N2O2
– DMG)
para formar o sólido vermelho Ni(C4
H7N2O2
)2(s) de acordo
com a reação:
Ni(NO3
)2(aq) + 2 C4
H8
N2
O2(aq) → Ni(C4
H7
N2
O2
)
2(s) + 2 HNO3(aq
Se uma amostra de 0.468 g contendo millerita
produz 0.206 g do sólido vermelho Ni(C4
H7
N2
O2
)2(s) , a
porcentagem de NiS na amostra é:
O sulfeto de níquel (II), NiS, ocorre na natureza como um mineral relativamente raro, a millerita. Uma de suas ocorrências é em meteoritos. Para se determinar a quantia de NiS em uma amostra do mineral, ela é tratada com ácido nítrico para liberar o níquel.
NiS(s) + 4HNO3(aq) → Ni(NO3)2(aq) + S(s) + 2NO2(g) + 2H2O(l)
A solução aquosa de Ni(NO3)2 é então tratada com o composto orgânico dimetilglioxima (C4H8N2O2 – DMG) para formar o sólido vermelho Ni(C4 H7N2O2 )2(s) de acordo com a reação:
Ni(NO3 )2(aq) + 2 C4 H8 N2 O2(aq) → Ni(C4 H7 N2 O2 ) 2(s) + 2 HNO3(aq
Se uma amostra de 0.468 g contendo millerita
produz 0.206 g do sólido vermelho Ni(C4
H7
N2
O2
)2(s) , a
porcentagem de NiS na amostra é:
Dois elementos genéricos X e Y apresentam as seguintes
distribuições eletrônicas por camadas: X(2, 8, 8, 1) e
Y(2, 8, 18, 6). Considerando-se uma provável ligação química
entre esses elementos (X e Y), afirma-se:
I O átomo X ganha 1 elétron e transforma-se em um cátion
monovalente.
II A fórmula do composto formado é X2Y.
III A ligação que ocorre entre eles é do tipo iônica.
IV O átomo Y cede 2 elétrons e transforma-se em um ânion
bivalente.
São corretas apenas as afirmações:
Dois elementos genéricos X e Y apresentam as seguintes distribuições eletrônicas por camadas: X(2, 8, 8, 1) e Y(2, 8, 18, 6). Considerando-se uma provável ligação química entre esses elementos (X e Y), afirma-se:
I O átomo X ganha 1 elétron e transforma-se em um cátion monovalente.
II A fórmula do composto formado é X2Y.
III A ligação que ocorre entre eles é do tipo iônica.
IV O átomo Y cede 2 elétrons e transforma-se em um ânion bivalente.
São corretas apenas as afirmações:
Em relação à Teoria Cinética dos Gases,
O mercúrio é um metal prateado que, em
temperatura ambiente, é líquido e inodoro. Quando a
temperatura é aumentada, transforma-se em vapor
tóxico e corrosivo. Trata-se de produto perigoso à saúde
quando inalado, ingerido ou em contato, causando
irritação na pele, olhos e vias respiratórias. Uma forma
de obtenção de mercúrio se dá por ustulação do sulfeto
de mercúrio II (ou cinábrio) segundo a reação:
HgS + O2 → Hg + SO2
Sabendo-se que o sulfeto de mercúrio II possui 70 % de
pureza, a massa de mercúrio produzida pela ustulação
de uma tonelada do composto é
O mercúrio é um metal prateado que, em temperatura ambiente, é líquido e inodoro. Quando a temperatura é aumentada, transforma-se em vapor tóxico e corrosivo. Trata-se de produto perigoso à saúde quando inalado, ingerido ou em contato, causando irritação na pele, olhos e vias respiratórias. Uma forma de obtenção de mercúrio se dá por ustulação do sulfeto de mercúrio II (ou cinábrio) segundo a reação:
HgS + O2 → Hg + SO2
O hélio é um gás monoatômico, incolor e inodoro,
que apresenta o menor ponto de evaporação de todos os
elementos químicos, e só pode ser solidificado sob
pressão elevada. Embora seja o segundo elemento
químico em abundância no universo, encontram-se, na
atmosfera terrestre, apenas traços provenientes da
desintegração de alguns de seus elementos. Em alguns
depósitos naturais de gás, é encontrado em quantidade
suficiente para a sua exploração. Estima-se que uma
reserva encontrada na Tanzânia contenha mais de 15
bilhões de metros cúbicos desse gás.
Considerando a densidade He = 0.18 kg/m³ , indique o número de átomos do gás hélio existente na reserva.
O hélio é um gás monoatômico, incolor e inodoro,
que apresenta o menor ponto de evaporação de todos os
elementos químicos, e só pode ser solidificado sob
pressão elevada. Embora seja o segundo elemento
químico em abundância no universo, encontram-se, na
atmosfera terrestre, apenas traços provenientes da
desintegração de alguns de seus elementos. Em alguns
depósitos naturais de gás, é encontrado em quantidade
suficiente para a sua exploração. Estima-se que uma
reserva encontrada na Tanzânia contenha mais de 15
bilhões de metros cúbicos desse gás.
Considerando a densidade He = 0.18 kg/m³ , indique o número de átomos do gás hélio existente na reserva.
A reação de combustão de um dos componentes
do gás de cozinha, o gás butano, pode ser representada
pela seguinte equação química não balanceada:
C4
H10(g) + O2(g) → CO2(g) + H2
O(l). Considerando que o
volume molar de um gás ideal, nas CNTP é 22.4 L/mol, é
correto afirmar:
Existem quatro números quânticos: número
quântico principal; número quântico de momento angular
ou azimutal (secundário); número quântico magnético e
número quântico de spin. Esses quatro números
quânticos, além de se complementarem, nos permitem
fazer uma descrição completa dos elétrons nos átomos,
pois eles representam o nível principal de energia do
elétron, o subnível de energia, a orientação espacial da
nuvem eletrônica e a orientação do próprio elétron na
nuvem.
Considerando as informações, dentre as seguintes séries
de números quânticos abaixo, aquela que descreve
corretamente um elétron em um dado átomo é:
Existem quatro números quânticos: número quântico principal; número quântico de momento angular ou azimutal (secundário); número quântico magnético e número quântico de spin. Esses quatro números quânticos, além de se complementarem, nos permitem fazer uma descrição completa dos elétrons nos átomos, pois eles representam o nível principal de energia do elétron, o subnível de energia, a orientação espacial da nuvem eletrônica e a orientação do próprio elétron na nuvem.
Considerando as informações, dentre as seguintes séries de números quânticos abaixo, aquela que descreve corretamente um elétron em um dado átomo é:
Para evitar bolor em armários, utilizam-se produtos
denominados “sais secantes", como o CaCl2
anidro, que
é higroscópico, isto é, capaz de absorver moléculas de
água. Por essa razão, o frasco contendo este secante
acaba por acumular líquido no fundo, que nada mais é do
que solução aquosa de cloreto de cálcio. Com base nessa
informação e utilizando – caso necessário – a tabela
periódica, analise as afirmativas a seguir:
I O cloreto de cálcio é um sólido iônico.
II O cloreto de cálcio sólido é um bom condutor de
eletricidade.
III Para ser usado como “secante de armário", o sal
deve ser higroscópico.
São verdadeiras:
I O cloreto de cálcio é um sólido iônico.
II O cloreto de cálcio sólido é um bom condutor de eletricidade.
III Para ser usado como “secante de armário", o sal deve ser higroscópico.
São verdadeiras:
A farinha de osso contém fosfato de cálcio obtido
pela calcinação de ossos de animais. O fosfato de cálcio
é também encontrado na crosta terrestre e constitui a
matéria-prima utilizada na produção do elemento fósforo.
Quando tratado com ácido sulfúrico, o fosfato de cálcio
produz fertilizante fosfatado. Considerando essas
informações, pode-se dizer que a fórmula molecular desse
sal produzido e a massa necessária para preparar 1,0 L
de solução M desse mesmo sal, respectivamente, são:
Foram dissolvidos em água 0,500 g de uma
amostra de sal comum (NaCl). À solução resultante
adicionou-se excesso de nitrato de prata, em meio de
ácido nítrico. O precipitado branco formado, separado por
filtração, lavado convenientemente e seco, pesou
1,148 g.
Assinale a resposta que apresenta a pureza da amostra
analisada.
Assinale a resposta que apresenta a pureza da amostra analisada.
Sabe-se que 40,0 mL de Sulfeto de Carbono(d = 1,43 gmL−1) são queimados numa atmosfera com excesso de O2(g). Considerando que o rendimento da queima foi de 80,0%, pode-se afirmar que a massa de SO2(g) produzida de acordo com a reação abaixo é de aproximadamente:
CS2(l) + 3O2(g) → CO2(g) + 2SO2(g)
CS2(l) + 3O2(g) → CO2(g) + 2SO2(g)
Em relação à reação química Al (s) + O2(g)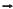 Al 2 O3(s) , não balanceada, pode-se afirmar que a massa de alumínio necessária para produzir 51 g de óxido de alumínio é
Al 2 O3(s) , não balanceada, pode-se afirmar que a massa de alumínio necessária para produzir 51 g de óxido de alumínio é
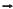 Al 2 O3(s) , não balanceada, pode-se afirmar que a massa de alumínio necessária para produzir 51 g de óxido de alumínio é
Al 2 O3(s) , não balanceada, pode-se afirmar que a massa de alumínio necessária para produzir 51 g de óxido de alumínio é