O metano é um gás natural produzido por matéria
orgânica em decomposição, sendo uma boa fonte
de calor. Determine o calor liberado por 11,2 litros
de metano na CNTP, utilizando o calor de
formação das substâncias na tabela.



I. NO(g) + 1/2 O2(g) → NO2(g) + 56.7kJ
II. 1/2 N2(g) + O2(g) → NO2(g) + 38,8Kj
III. 1/2 N2(g) + 1/2 O2(g) → NO(g)
De acordo com os estudos de Germain Henry Hess, professor da Universidade de São Petersburgo, no século XIX, a variação de entalpia em uma reação química depende apenas dos estados inicial e final de reagentes e de produtos da reação. A Lei de Hess contribuiu para o nascimento do princípio da conservação de energia.
A partir da aplicação da Lei de Hess, ao sistema de equações
termoquímicas I e II, é possível calcular a variação de entalpia
da reação representada pela equação química III.
Dessa forma, é correto afirmar:

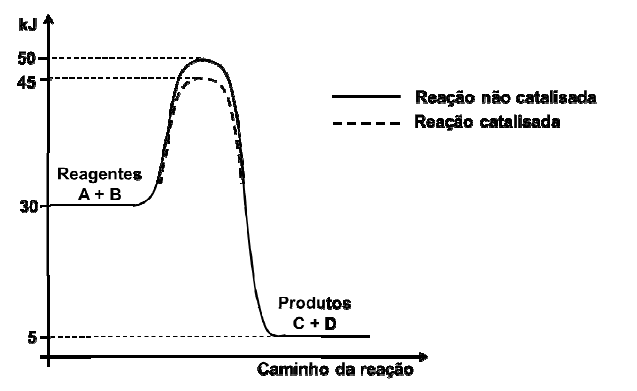
O diagrama representa a entalpia de formação do pentacloreto de fósforo a partir de duas variedades alotrópicas de fósforo, o fósforo branco e o fósforo vermelho.
A partir da análise desse diagrama, é correto afirmar:

Apressão de vapor é uma importante propriedade físico-química das substâncias e das soluções.
Com base nos dados fornecidos e nos conhecimentos de química, é correto afirmar:

Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:
As propriedades físico-químicas das substâncias são afetadas pelas interações intra e intermoleculares.
Com base nos conhecimentos de química e nos dados da tabela, é correto afirmar:
A entalpia normal de vaporização do metanol é maior que a do metano.

Fazer a mala para uma viagem poderá ser tão simples como pegar algumas latas de spray, que contenham uma mistura de polímero coloidal, para fazer suas próprias roupas “spray-on”. Tanto faz se é uma camiseta ou um traje noturno, o tecido “spray-on” é uma novidade para produzir uma variedade de tecidos leves. A fórmula consiste em fibras curtas interligadas com polímeros e um solvente que produz o tecido em forma líquida. Esse tecido provoca uma sensação fria ao ser pulverizado no corpo, mas adquire a temperatura corporal em poucos segundos. O material é pulverizado diretamente sobre a pele nua de uma pessoa, onde seca quase instantaneamente.

(http://tinyurl.com/qermcv6 Acesso em: 29.08.2014. Adaptado. Original colorido)
A sensação térmica provocada pelo tecido “spray-on”,
quando pulverizado sobre o corpo, ocorre porque o
solvente
O poder calorífico de um gás liquefeito é conhecido como a quantidade de energia liberada pela sua queima. Se o poder calorífico do propano é cerca de 50 kJ/g, assinale a alternativa que apresenta, corretamente, o volume, em m3 , de propano que deve ser queimado para liberar 1,0×103 kJ de energia, à temperatura de 20 ◦C e 1 atmosfera.
Dados: Massa molar do propano = 44,1 g/mol
Leia o texto para responder a questão.
De onde vem o cheiro de carro novo?
De acordo com o gerente de uma montadora de veículos, o cheiro é composto por uma combinação de vários tipos de substâncias químicas usadas na fabricação do veículo, incluindo solventes, plásticos, colas, tecidos e borracha. Porém, muitas delas são altamente tóxicas, porque contêm Compostos Orgânicos Voláteis (COVs) em sua composição, como benzeno, tolueno e formol, que podem ser letais dependendo da quantidade. Eles acabam escapando e impregnando o ar, porque não requerem altas temperaturas para evaporarem.
<http://tinyurl.com/y8ucob6c> Acesso em: 13.11.2017. Adaptado.
Dadas as entalpias de formação dos compostos:
CO2(g) ΔHf = - 393 kJ/mol
H2O ΔHf = - 286 kJ/mol
ΔHf = - 286 kJ/mol
conclui-se, corretamente, que a entalpia de formação do combustível presente em I é, em kJ/mol,
 + 3O2(g) → 2CO2 (g) + 3H2O
+ 3O2(g) → 2CO2 (g) + 3H2O  ΔH = - 1366,8kJ
ΔH = - 1366,8kJ + 25/2 O2(g) → 8 CO2(g) + 9 H2O
+ 25/2 O2(g) → 8 CO2(g) + 9 H2O  ΔH = –5 461,0 kJ
ΔH = –5 461,0 kJ
I. C2H2(g) + 5/2 O2(g) ➝ 2CO2(g) + H2O ΔHº = - 1299,6 kJ
II. C(graf.) + O2(g) ➝ CO2 ΔHº = 393,5kJ
III. H2(g) + 1/2 O2(g) ➝ H2O ΔHº = -285,8kJ
IV. 2C(graf;) + H2(g) ➝ C2H2(g)
Em virtude de a entalpia, H, ser uma função de estado, a sua variação, ΔH, associada a qualquer processo químico, depende unicamente da natureza do estado inicial dos reagentes e do estado final dos produtos. Assim, uma determinada reação química pode ocorrer em uma única etapa ou em uma série de etapas.
Tendo em vista essas considerações sobre a variação de
entalpia de uma reação química, é correto afirmar:
O besouro-bombardeiro consegue afastar seus predadores, lançando sobre eles um jato quente e repelente de quinona, substância produzida em seu abdômen, através da reação química entre hidroquinina e peróxido de hidrogênio. O fenômeno pode ser representado pela equação:
C6 H6 O2(aq) + H2O2(aq) → C6 H4O2(aq) + 2H2 O ∆H = –204 kJ/mol
Hidroquinona Quinona
