Questão 2c42b0e0-b0
Prova:FATEC 2013
Disciplina:Química
Assunto:Transformações Químicas e Energia, Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess.
Dadas as entalpias de formação dos compostos:
CO2(g) ΔHf = - 393 kJ/mol
H2O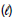 ΔHf = - 286 kJ/mol
ΔHf = - 286 kJ/mol
conclui-se, corretamente, que a entalpia de formação do combustível presente em I é, em kJ/mol,
Dadas as entalpias de formação dos compostos:
CO2(g) ΔHf = - 393 kJ/mol
H2O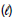 ΔHf = - 286 kJ/mol
ΔHf = - 286 kJ/mol
conclui-se, corretamente, que a entalpia de formação do combustível presente em I é, em kJ/mol,
Leia o texto para responder a questão.
O aumento da demanda de energia é uma das principais preocupações da sociedade contemporânea.
A seguir, temos equações termoquímicas de dois combustíveis muito utilizados para a produção de energia.
I. CH3 – CH2 – OH + 3O2(g) → 2CO2 (g) + 3H2O
+ 3O2(g) → 2CO2 (g) + 3H2O  ΔH = - 1366,8kJ
ΔH = - 1366,8kJ
II.  + 25/2 O2(g) → 8 CO2(g) + 9 H2O
+ 25/2 O2(g) → 8 CO2(g) + 9 H2O  ΔH = –5 461,0 kJ
ΔH = –5 461,0 kJ
Leia o texto para responder a questão.
O aumento da demanda de energia é uma das principais preocupações da sociedade contemporânea.
A seguir, temos equações termoquímicas de dois combustíveis muito utilizados para a produção de energia.
I. CH3 – CH2 – OH + 3O2(g) → 2CO2 (g) + 3H2O
+ 3O2(g) → 2CO2 (g) + 3H2O  ΔH = - 1366,8kJ
ΔH = - 1366,8kJ
 + 3O2(g) → 2CO2 (g) + 3H2O
+ 3O2(g) → 2CO2 (g) + 3H2O  ΔH = - 1366,8kJ
ΔH = - 1366,8kJII.  + 25/2 O2(g) → 8 CO2(g) + 9 H2O
+ 25/2 O2(g) → 8 CO2(g) + 9 H2O  ΔH = –5 461,0 kJ
ΔH = –5 461,0 kJ
 + 25/2 O2(g) → 8 CO2(g) + 9 H2O
+ 25/2 O2(g) → 8 CO2(g) + 9 H2O  ΔH = –5 461,0 kJ
ΔH = –5 461,0 kJA
–107,5.
B
+107,5.
C
–277,2.
D
+277,2.
E
+687,7.






