Questõessobre Soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais.
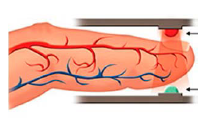
O oxímetro é usado na
triagem para a Covid-19.
Acoplado ao dedo, ele
emite luz em dois
comprimentos de onda
(660 nm e 940 nm) e mede
a quantidade de luz
absorvida (A) em cada caso. A partir disso, determina a
concentração percentual de oxi-hemoglobina (HbO2) e de
desoxi-hemoglobina (Hb) no sangue. Valores entre 95 e
100% para HbO2 indicam normalidade. Simplificadamente,
as quantidades de luz absorvidas em cada comprimento de
onda (A) se relacionam matematicamente às
concentrações [HbO2] e [Hb] conforme as seguintes
equações:
Hb (aq) + O2 (aq) ➝ HbO2 (aq)
A (em 660 nm) = 320 [HbO2] + 3227 [Hb]
A (em 940 nm)= 1214 [HbO2] + 693 [Hb].
Considere que uma pessoa tenha chegado ao hospital com
baixa saturação de O2 no sangue e, depois de submetida à
oxigenoterapia, começa a ter a saturação normalizada. Em
relação às medidas iniciais, quando a saturação de O2
começa a subir, a absorção de luz indicada pelo oxímetro

A forma cristalina de um fármaco é fundamental para seu
uso como medicamento. Assim, a indústria farmacêutica,
após a síntese de determinado fármaco, deve verificar se
ele se apresenta como uma única forma cristalina ou se é
uma mistura polimórfica. Uma das formas de purificar um
fármaco nessas condições é utilizar um processo de
recristalização: dissolução do material sintetizado, seguida
da cristalização da substância desejada. Observe na tabela
abaixo os dados de solubilidade em água de uma dada
forma de insulina.
Temperatura (ºC) Solubilidade (mg mL-1) 15 0,30
25 0,63
35 0,92
A partir dessas informações, caso se queira purificar uma
amostra dessa insulina, seria recomendado dissolver essa
amostra em quantidade suficiente de água
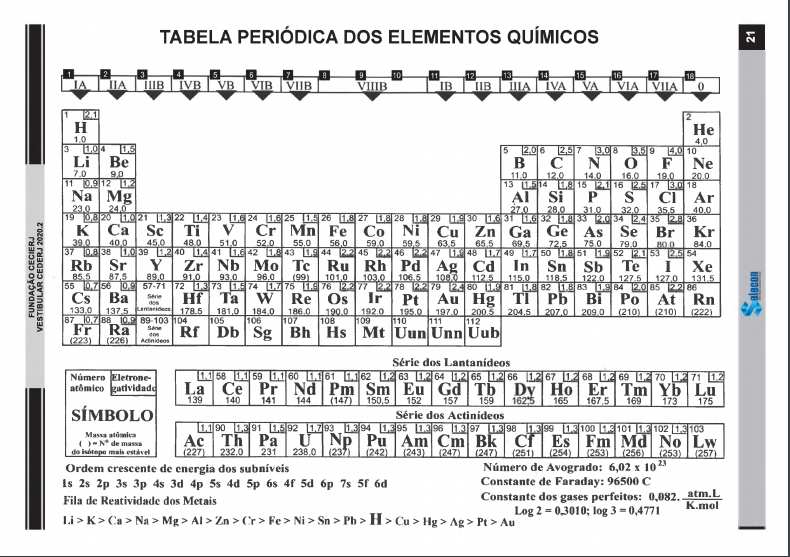
Massas molares em g mol-1: Na = 23; Mg = 24; Cl = 35,5; K = 39; Ca = 40.
Imagine-se como um dos coautores de um trabalho científico sobre a capacidade de dessalinização de fibras de carbono poroso (PCF). Ao revisar os dados da pesquisa, você observa que os resultados apresentados no gráfico a seguir estão consistentes para MgCl2 e CaCl2, do ponto de vista do conhecimento químico.
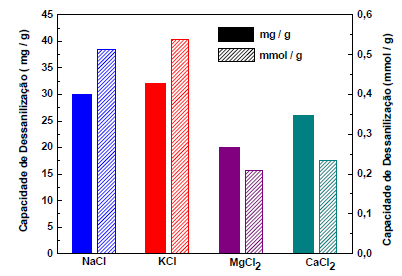
No entanto, você também observa no gráfico que a apresentação dos dados está

Muitos laboratórios armazenam em seus
estoques soluções concentradas de reagentes. Um
técnico responsável dispõe, em seu laboratório, de
uma solução de etanol (álcool absoluto) a 16,3 mol/L.
O volume de água, em litros, que deve ser adicionado
a 400 mL de solução de etanol a 16,3 mol/L (álcool
absoluto) para produzir etanol hidratado a 70 % v/v é,
aproximadamente:
(Dado: detanol = 0,8 g/mL)
Muitos laboratórios armazenam em seus estoques soluções concentradas de reagentes. Um técnico responsável dispõe, em seu laboratório, de uma solução de etanol (álcool absoluto) a 16,3 mol/L. O volume de água, em litros, que deve ser adicionado a 400 mL de solução de etanol a 16,3 mol/L (álcool absoluto) para produzir etanol hidratado a 70 % v/v é, aproximadamente:
(Dado: detanol = 0,8 g/mL)
Na Medicina Nuclear, é comum a utilização de radioisótopos para diagnóstico ou intervenção
terapêutica. 32P (32 g/mol) e 131I (131 g/mol), que são amplamente utilizados nesse campo da
medicina, têm tempos de meia-vida de 14 e 8 dias, respectivamente. Fosfato de crômio (CrPO4)
coloidal e Iodeto de sódio (NaI) são exemplos de radiofármacos empregados para esse fim.
Considerando que doses equivalentes a 2,0x10-3 mol desses radiofármacos são administradas no
mesmo instante, assinale a alternativa que apresenta as massas desses radioisótopos contidas nos
corpos dos pacientes, após 56 dias da administração.
Muitas vezes, o ser humano procura alterar suas características naturais. Uma informação noticiada pelos
jornais informa que “Mais da metade dos salões de beleza do Rio de Janeiro e de São Paulo oferecem
alisamento com formol – embora a utilização do produto como alisador seja proibida pela Anvisa.” (Folha de
São Paulo, 14/10/2010)

O formol é uma solução aquosa de metanal a 40% (em massa) e com densidade 0,92 g/mL. Sobre essa solução,
pode-se afirmar que apresenta:

Um comprimido de 1 g de analgésico, que contém 540
mg de ácido acetilsalicílico (AAS), foi totalmente
dissolvido em etanol para a preparação de 10 mL de
solução. A figura representa a fórmula estrutural AAS.

Dados:
C = 12,0; H = 1,0; O = 16,0 g/mol.
A concentração, em mol/L, de
AAS na solução é

Considere duas bebidas comerciais açucaradas:
Bebida I – 600 mL de refrigerante, contendo
10 colheres de chá de sacarose (C12H22O11).
Bebida II – 1,0 L de suco de maçã com 0,30 mol de
sacarose.
Se 1 colher de chá contém 5,0 g de sacarose, e
C = 12,0; H = 1,0; O = 16,0 g/mol, é correto afirmar
que
Um frasco contendo 500 g de mel produzido no Brasil foi
analisado e concluiu-se que 0,2 milimol de frutose foi
convertido em HMF. Considerando apenas esse parâmetro de
qualidade e tendo como referência os teores recomendados
por órgãos nacionais e internacionais, mostrados na tabela, é
correto afirmar que esse mel
Note e adote:
Massa molar (g/mol): HMF = 126
Desconsidere qualquer possibilidade de contaminação do mel por fonte externa de HMF.
Note e adote:
Massa molar (g/mol): HMF = 126
Desconsidere qualquer possibilidade de contaminação do mel por fonte externa de HMF.
Um dos indicadores de qualidade de mel é a presença do composto orgânico hidroximetilfurfural (HMF), formado a partir de certos açúcares, como a frutose (C6H12O6). A tabela resume os teores de HMF permitidos de acordo com a legislação brasileira e recomendações internacionais.

Uma das possíveis rotas para a formação do HMF a partir da frutose é mostrada, de forma simplificada, no esquema:

Nas setas, são mostradas as perdas de moléculas ou grupos
químicos em cada etapa. Por exemplo, entre as espécies 1 e 2,
ocorrem a saída de uma molécula de água e a formação de uma
ligação dupla entre carbonos.
não pode ser usado para qualquer aplicação, tanto segundo a legislação brasileira quanto segundo a recomendação internacional.
A concentração, em mol/L, de chumbo encontrada no rio Doce é, aproximadamente, de
Dado:
Massa Molar:
Pb = 207 g/mol
A concentração, em mol/L, de chumbo encontrada no rio Doce é, aproximadamente, de
Dado:
Massa Molar:
Pb = 207 g/mol
Um agricultor da cidade do
Crato, necessita repor alguns nutrientes para o
controle do amolecimento interno da polpa da
manga Tommy a qual cultiva no seu sítio. Para
repor uma carência de Ca
+2 em sua plantação
de mangas ele precisa preparar 10L de Ca a
3%. Qual a massa de cloreto de cálcio que ele
precisa para tal operação?
(dados: CaCl2 = 111g e considere a densidade =
1 g/cm3 ou kg/dm3
.
Um agricultor da cidade do Crato, necessita repor alguns nutrientes para o controle do amolecimento interno da polpa da manga Tommy a qual cultiva no seu sítio. Para repor uma carência de Ca +2 em sua plantação de mangas ele precisa preparar 10L de Ca a 3%. Qual a massa de cloreto de cálcio que ele precisa para tal operação?
(dados: CaCl2 = 111g e considere a densidade =
1 g/cm3 ou kg/dm3
.
Dois Técnicos de uma
empresa Ambiental da Chapada do Araripe, coletaram amostras de água de um córrego
para analisar fósforo e nitrogênio. Para tanto
precisam preparar duas soluções uma de
(KH2PO4) e outra de (KNO3), ambas de mesma
concentração em mol/L. Sabendo que a solução
de KH2PO4 é preparada adicionando-se água a
6,8g do sal até o volume final de 500 mL. A
outra deve ser preparada adicionando água ao
KNO3 para obter 200 mL de solução.
Com base nas informações, qual a massa
necessária de KNO3.
O álcool isopropílico (CH3
CH(OH)CH3
), entre outras aplicações, é empregado na limpeza de circuitos eletrônicos. Em
um experimento, um estudante utilizou um frasco conta-gotas com álcool isopropílico a 20 ºC e verificou que eram
necessárias 65 gotas desse álcool para perfazer o volume
de 2 mL. Sabendo que a densidade do álcool isopropílico
nessa temperatura é aproximadamente 0,8 g/mL, a quantidade desse álcool, em mol de moléculas, presente em cada
gota é próxima de

O crescimento da frota de veículos em circulação
no mundo tem levado à busca e desenvolvimento
de tecnologias que permitam minimizar emissões de
poluentes atmosféricos. O uso de veículos elétricos é
uma das propostas mais propagandeadas por serem de
emissão zero. Podemos comparar a emissão de carbono
na forma de CO2 (massa molar igual a 44 g mol-1) para os
dois tipos de carros (a combustão e elétrico). Considere que os veículos tradicionais a combustão, movidos a
etanol (massa molar igual a 46 g mol-1), emitem uma
média de 2,6 mol de CO2 por quilômetro rodado, e os
elétricos emitem o equivalente a 0,45 mol de CO2 por
quilômetro rodado (considerando as emissões na geração
e transmissão da eletricidade). A reação de combustão
do etanol pode ser representada pela equação química:
C2H5OH (I) + 3 O2 (g) → 2 CO2 (g) + 3 H2O (g)
Foram analisadas as emissões de CO2 envolvidas
em dois veículos, um movido a etanol e outro elétrico,
em um mesmo trajeto de 1.000 km.
CHIARADIA, C. A. Estudo da viabilidade da implantação de frotas de veículos elétricos
e híbridos elétricos no atual cenário econômico, político, energético e ambiental brasileiro.
Guaratinguetá: Unesp. 2015 (adaptado).
A quantidade equivalente de etanol economizada, em
quilograma, com o uso do veículo elétrico nesse trajeto,
é mais próxima de
A sacarase (ou invertase) é uma enzima que atua no
intestino humano hidrolisando o dissacarídeo sacarose
nos monossacarídeos glicose e frutose. Em um estudo
cinético da reação de hidrólise da sacarose (C12H22O11),
foram dissolvidos 171 g de sacarose em 500 mL de
água. Observou-se que, a cada 100 minutos de reação,
a concentração de sacarose foi reduzida à metade,
qualquer que fosse o momento escolhido como tempo
inicial. As massas molares dos elementos H, C e O são
iguais a 1, 12 e 16 g mol-1, respectivamente.
Qual é a concentração de sacarose depois de 400 minutos
do início da reação de hidrólise?
2,50 x 10-3 mol L-1
O texto abaixo está presente na legislação que institui o Código de Trânsito Brasileiro- CTB.
“[...]Conduzir veículo automotor, na via pública, estando com concentração de álcool por litro de sangue igual ou superior a 6 (seis) decigramas, ou sob a influência de qualquer outra substância psicoativa que determine dependência: Penas - detenção, de seis meses a três anos, multa e suspensão ou proibição de se obter a permissão ou a habilitação para dirigir veículo automotor. [...]”
Um condutor automotivo parado em uma operação policial, após ser submetido a análises técnicas, apresentou uma concentração de 21 decigramas de álcool por litro de sangue.
Com base no texto acima e nos conceitos químicos, analise as afirmações a seguir.
I- A concentração de álcool no sangue desse condutor é de 2,1μg/μL.
II- O condutor deverá ser penalizado segundo a legislação do CTB.
III- Caso o condutor possua em seu organismo um volume de sangue igual a 5,0 L, a quantidade de álcool presente em seu corpo é de 10,5 g.
IV - A combustão completa do etanol geral CO e água.
Assinale a alternativa correta.
O texto abaixo está presente na legislação que institui o Código de Trânsito Brasileiro- CTB.
“[...]Conduzir veículo automotor, na via pública, estando com concentração de álcool por litro de sangue igual ou superior a 6 (seis) decigramas, ou sob a influência de qualquer outra substância psicoativa que determine dependência: Penas - detenção, de seis meses a três anos, multa e suspensão ou proibição de se obter a permissão ou a habilitação para dirigir veículo automotor. [...]”
Um condutor automotivo parado em uma operação policial, após ser submetido a análises técnicas, apresentou uma concentração de 21 decigramas de álcool por litro de sangue.
Com base no texto acima e nos conceitos químicos, analise as afirmações a seguir.
I- A concentração de álcool no sangue desse condutor é de 2,1μg/μL.
II- O condutor deverá ser penalizado segundo a legislação do CTB.
III- Caso o condutor possua em seu organismo um volume de sangue igual a 5,0 L, a quantidade de álcool presente em seu corpo é de 10,5 g.
IV - A combustão completa do etanol geral CO e água.
Assinale a alternativa correta.
Em sua aula sobre diluição de soluções, um professor de
Química mostrou a seus alunos cinco imagens e perguntou a
eles qual delas representa o procedimento apropriado para
se obterem 50,0 mL de uma solução de ácido clorídrico
0,2 mol/L, dispondo-se de 1,0 L de solução de ácido clorídrico
2,0 mol/L.
O aluno que respondeu corretamente falou que a forma
adequada para se chegar ao resultado esperado está
representada na alternativa
Massas molares, em g/mol: H = 1, O = 16, Cl = 35,5





O gráfico a seguir mostra a relação entre o número de
átomos de carbono e a solubilidade em água de uma série
de ácidos dicarboxílicos.

Disponível em:
<http://www.profpc.com.br/Qu%C3%ADmica%20na%20Cozinha/
Qu%C3%ADmica%20dos%20Sentidos/Qu%C3%ADmica_sentidos.htm#PO
NTO_DE_FUS%C3%83O_E_PONTO_DE_EBULI%C3%87% C3%83º>.
Acesso em: 9 ago. 2018.
De acordo com esse gráfico, a solubilidade em água do
ácido succínico é aproximadamente 6,8 g/mL. A fórmula
química desse ácido é
O gráfico a seguir mostra a relação entre o número de átomos de carbono e a solubilidade em água de uma série de ácidos dicarboxílicos.

Disponível em:
<http://www.profpc.com.br/Qu%C3%ADmica%20na%20Cozinha/
Qu%C3%ADmica%20dos%20Sentidos/Qu%C3%ADmica_sentidos.htm#PO
NTO_DE_FUS%C3%83O_E_PONTO_DE_EBULI%C3%87% C3%83º>.
Acesso em: 9 ago. 2018.
De acordo com esse gráfico, a solubilidade em água do
ácido succínico é aproximadamente 6,8 g/mL. A fórmula
química desse ácido é
PESQUISA GERA CACHAÇA “TIPO EXPORTAÇÃO”
Método ajuda a diminuir teor de cobre na
bebida, vencendo regras do mercado internacional para
consumo de destilados. Brasil permite até 5 mg/L do metal
na aguardente, mas a Europa exige um máximo de 2 mg/L;
a técnica não muda o sabor ou o aroma do produto.
[...] Para retirar o metal da bebida, os
pesquisadores [...] misturaram à cachaça recém-destilada
mármore ou calcário em pó, ambos formados
basicamente por carbonato de cálcio. [...] é como se o
carbonato “largasse” o cálcio e agarrasse o cobre,
formando um precipitado - uma espécie de pó, que é
facilmente retirado por uma filtragem. “Conseguimos
fazer que uma bebida que tinha 20 mg/L de cobre chegue
a 2 mg/L”, diz Oliveira.
Disponível em:
http://www.ufcg.edu.br/prt_ufcg/assessoria_impre
nsa/mostra_noticia.php?codigo=2905.
Acesso em: 16 de agosto de 2015.
[Dados: M(Ca) = 40 g/mol; M(Cu) = 63,5 g/mol.]
A análise dos dados permite inferir que
PESQUISA GERA CACHAÇA “TIPO EXPORTAÇÃO”
Método ajuda a diminuir teor de cobre na bebida, vencendo regras do mercado internacional para consumo de destilados. Brasil permite até 5 mg/L do metal na aguardente, mas a Europa exige um máximo de 2 mg/L; a técnica não muda o sabor ou o aroma do produto.
[...] Para retirar o metal da bebida, os pesquisadores [...] misturaram à cachaça recém-destilada mármore ou calcário em pó, ambos formados basicamente por carbonato de cálcio. [...] é como se o carbonato “largasse” o cálcio e agarrasse o cobre, formando um precipitado - uma espécie de pó, que é facilmente retirado por uma filtragem. “Conseguimos fazer que uma bebida que tinha 20 mg/L de cobre chegue a 2 mg/L”, diz Oliveira.
Disponível em: http://www.ufcg.edu.br/prt_ufcg/assessoria_impre nsa/mostra_noticia.php?codigo=2905. Acesso em: 16 de agosto de 2015.
[Dados: M(Ca) = 40 g/mol; M(Cu) = 63,5 g/mol.]
A análise dos dados permite inferir que