Questõessobre Sistemas Homogêneos: Solubilidade dos Sais, Hidrólise dos Sais e Curvas de Titulação.
O carbonato de sódio utilizado na produção de
vidro, papel, sabões e detergentes, quando dissolvido
em água, separa dois íons. Sobre esse processo, é
correto afirmar que
DADOS QUE PODEM SER USADOS NESTA PROVA

Crime no Museu! Uma estatueta em bronze, constituída por 90% de cobre e 10% de alumínio, foi roubada. Depois
de alguns dias, uma estatueta, com características semelhantes foi encontrada, aos pedaços, em uma lixeira. Foi
realizada uma análise para confirmar sua autenticidade, pois a composição desta estatueta poderia ser de latão,
constituída de 90% de cobre e 10% de zinco. Primeiramente, massas de 0,50 g retiradas dos pedaços encontrados
foram dissolvidas em HNO3 5,0 mol L−1, formando íons em solução. Em seguida, alíquotas dessa solução ácida
foram alcalinizadas com solução de NaOH para a formação de precipitados azul e branco visualmente distinguíveis
e, na sequência, foram adicionadas soluções aquosas de NH4Cl. As equações químicas das reações que podem
ocorrer com a adição dos reagentes são apresentadas a seguir:

Com base no texto e nas equações químicas, assinale a alternativa que apresenta, corretamente, o resultado
experimental que comprova que a estatueta encontrada na lixeira é de bronze.

Um técnico preparou 420g de uma solução saturada de nitrato de potássio (KNO3, dissolvida em água) em um béquer a uma temperatura de 60ºC. Depois deixou a solução esfriar até uma temperatura de 40ºC, verificando a presença de um precipitado.
A massa aproximada desse precipitado é:
(desconsidere a massa de água presente no precipitado)

Um técnico preparou 420g de uma solução saturada de nitrato de potássio (KNO3, dissolvida em água) em um béquer a uma temperatura de 60ºC. Depois deixou a solução esfriar até uma temperatura de 40ºC, verificando a presença de um precipitado.
A massa aproximada desse precipitado é:
(desconsidere a massa de água presente no precipitado)

Observe a curva de titulação de uma solução aquosa de
ácido acético 1 mol/L com solução aquosa de hidróxido de
sódio 1 mol/L.
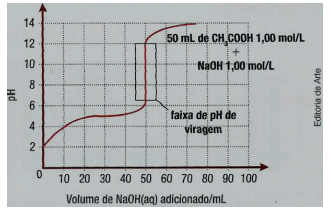
MASTERTON, W. L.; SLOWINSKI, E. J. Química geral superior.
4 ed. Rio de Janeiro: Interamericana, 1978, p. 392.
De acordo com os dados apresentados, é pertinente inferir
que
Observe a curva de titulação de uma solução aquosa de ácido acético 1 mol/L com solução aquosa de hidróxido de sódio 1 mol/L.

MASTERTON, W. L.; SLOWINSKI, E. J. Química geral superior.
4 ed. Rio de Janeiro: Interamericana, 1978, p. 392.
De acordo com os dados apresentados, é pertinente inferir
que
[...] “Solos ácidos, caracterizados por baixos valores
de pH [...], teores insuficientes de cálcio e excesso de
alumínio e/ou manganês, [...] limitam fortemente a
produtividade das culturas, pois impedem absorção plena
dos nutrientes pela plantas.” [...]
Disponível em: http://www.estadao.com.br/noticias/geral,
e-hora-de-aplicar-calcario-no-solo,218382.
Acesso em: 15 de agosto de 2015.
Para tornar o solo adequado a uma boa produtividade,
pode-se inferir que o agricultor deverá usar
[...] “Solos ácidos, caracterizados por baixos valores de pH [...], teores insuficientes de cálcio e excesso de alumínio e/ou manganês, [...] limitam fortemente a produtividade das culturas, pois impedem absorção plena dos nutrientes pela plantas.” [...]
Disponível em: http://www.estadao.com.br/noticias/geral, e-hora-de-aplicar-calcario-no-solo,218382. Acesso em: 15 de agosto de 2015.
Para tornar o solo adequado a uma boa produtividade, pode-se inferir que o agricultor deverá usar
A ÁGUA
A água é o melhor solvente que existe. O pH é
determinado por meio de uma escala universal graduada
de 0 a 14, a 25 °C, sendo 7 o ponto correspondente à
neutralidade. Portanto, quando a água tem um pH inferior
a 7, diz-se que a água é ácida; se é igual a 7, diz-se que é
neutra e, se é superior a 7, diz-se que a água é alcalina.
É importante saber que, em condições de saúde, o líquido
intracelular e o extracelular apresentam um pH que
oscila entre 7,35 e 7,45, ou seja, levemente alcalino.
Nosso organismo tende à alcalinidade, então a água
saudável deve ser alcalina.
Disponível em:<http://phsaude.blogspot.com.br/2014/07/o-que-e-ph.html> .
Acesso em: 7 de agosto de 2016.
Qual das substâncias a seguir se deve adicionar à água que
será consumida por um indivíduo, para torná-la saudável?
A ÁGUA
A água é o melhor solvente que existe. O pH é determinado por meio de uma escala universal graduada de 0 a 14, a 25 °C, sendo 7 o ponto correspondente à neutralidade. Portanto, quando a água tem um pH inferior a 7, diz-se que a água é ácida; se é igual a 7, diz-se que é neutra e, se é superior a 7, diz-se que a água é alcalina. É importante saber que, em condições de saúde, o líquido intracelular e o extracelular apresentam um pH que oscila entre 7,35 e 7,45, ou seja, levemente alcalino. Nosso organismo tende à alcalinidade, então a água saudável deve ser alcalina.
Disponível em:<http://phsaude.blogspot.com.br/2014/07/o-que-e-ph.html>
SOLUÇÃO-TAMPÃO: DEFINIÇÃO CONTEMPORÂNEA
Hoje, o conceito de tampão é aplicado nas
diversas áreas do conhecimento. Bioquímicos utilizam
tampões devido ao fato de as propriedades de qualquer
sistema biológico ser dependente do pH; além disso, em
química analítica e industrial, o controle adequado do pH
pode ser essencial na determinação das extensões de
reações de precipitação e de eletrodeposição de metais,
na efetividade de separações químicas, nas sínteses
químicas em geral e no controle de mecanismos de
oxidação e reações eletródicas. Uma definição mais
abrangente foi apresentada, recentemente, por Harris
(1999): uma solução tamponada resiste a mudanças de pH
quando ácidos ou bases são adicionados ou quando
uma diluição ocorre. Embora haja outros tipos de
solução-tampão, essas soluções são constituídas
geralmente de uma mistura de um ácido fraco e sua base
conjugada (exemplo: ácido acético e acetato de sódio) ou
da mistura de uma base fraca e seu ácido conjugado
(exemplo: amônia e cloreto de amônio).
Disponível em:<http://qnesc.sbq.org.br/online/qnesc13/v13a04.pdf> .
Acesso em: 07 de agosto de 2016.
Em um laboratório de Química, uma solução-tampão foi
preparada pela mistura de 250 mL de uma solução aquosa
de ácido etanoico (H3CCOOH) 0,20 mol/L com 250 mL de
solução aquosa de hidróxido de sódio (NaOH) 0,10 mol/L.
Qual o pH da solução obtida?
Dado: pKa do ácido etanoico = 4,75; log 2 = 0,3
SOLUÇÃO-TAMPÃO: DEFINIÇÃO CONTEMPORÂNEA
Hoje, o conceito de tampão é aplicado nas diversas áreas do conhecimento. Bioquímicos utilizam tampões devido ao fato de as propriedades de qualquer sistema biológico ser dependente do pH; além disso, em química analítica e industrial, o controle adequado do pH pode ser essencial na determinação das extensões de reações de precipitação e de eletrodeposição de metais, na efetividade de separações químicas, nas sínteses químicas em geral e no controle de mecanismos de oxidação e reações eletródicas. Uma definição mais abrangente foi apresentada, recentemente, por Harris (1999): uma solução tamponada resiste a mudanças de pH quando ácidos ou bases são adicionados ou quando uma diluição ocorre. Embora haja outros tipos de solução-tampão, essas soluções são constituídas geralmente de uma mistura de um ácido fraco e sua base conjugada (exemplo: ácido acético e acetato de sódio) ou da mistura de uma base fraca e seu ácido conjugado (exemplo: amônia e cloreto de amônio).
Disponível em:<http://qnesc.sbq.org.br/online/qnesc13/v13a04.pdf>
O sulfato de amônio é um fertilizante muito empregado nas lavouras por fornecer macronutrientes
primários e secundários às plantas. Porém, não deve ser usado por anos seguidos no solo devido ao
fato de que:
O fogo causado pela queima de óleo de cozinha ou gordura é bem mais difícil de se apagar do que o de outros líquidos
inflamáveis, o que demandou a criação dos extintores classe K. Tais extintores são preenchidos com uma solução
alcalina que causa a saponificação do óleo ou gordura, produzindo uma espuma que abafa a chama. No quadro abaixo,
são listadas as propriedades de cinco substâncias.

Qual das substâncias acima é a adequada para se preparar a solução de preenchimento desse tipo de extintor?

Os principais parâmetros que definem a qualidade da água de uma piscina são o pH e a alcalinidade. Para a água ser
considerada própria, o pH deve ser mantido próximo de 7,0, para garantir o conforto do banhista e a eficácia dos
agentes bactericidas. Já a alcalinidade, expressa em concentração de íon bicarbonato, deve ser em torno de 100 g m-3. A
propriedade anfotérica desse íon garante que qualquer substância ácida ou básica introduzida seja prontamente
neutralizada, conforme mostram as equações químicas abaixo:

Ao adicionar carbonato de sódio na água de uma piscina, que está em condições consideradas adequadas para o
banho, ocorrerá:


O gráfico representa a variação do coeficiente de solubilidade
de nitrato de potássio com a temperatura.
Uma análise desse gráfico permite afirmar:

Alguns sais, em soluções aquosas, modificam a concentração
de íons H+ e OH-
do meio, dependendo da força ácida ou básica de
quem lhes deu origem. A adição de íons comuns aos existentes
nas soluções destes sais podem, ou não, modificar o pH. É
importante saber como se comportam esses sistemas de soluções
salinas com adição de ácidos ou bases, pois eles são identificados
como reguladores de muitos sistemas biológicos, a exemplo da
regulação do pH do sangue no organismo humano, dentre outros.
Analise os sistemas descritos e assinale a proposição correta:
Existem sais que são muito solúveis em água e existem outros cuja solubilidade é muito pequena. Sobre essas substâncias, analise
as afirmativas.
I - Colocando-se, em água, uma quantidade de sal superior à sua solubilidade, obtém-se uma solução saturada em equilíbrio com
a porção do sal não dissolvida, formando um sistema homogêneo.
II - Detecta-se experimentalmente que as concentrações dos íons H3O+ e OH−
para as soluções salinas podem ou não ser
alteradas em relação às da água pura e que soluções de cloreto de amônio (NH4Cl) são alteradas, com a concentração de
H3O+ aumentando e de OH− diminuindo, assim, tem-se que soluções de cloreto de amônio são ácidas.
III - Sais que formam soluções básicas têm um ânion capaz de reagir com a água, alterando, para maior, a concentração do
íon OH−
.
IV - A reação de hidrólise de qualquer sal ocorre sempre com a formação de um ácido ou uma base fraca.
Estão corretas as afirmativas

No processo Dow, de extração de magnésio, da água do mar,
sob a forma de íons Mg2+(aq), representado pelo fluxograma,
hidróxido de cálcio, Ca(OH)2(aq), é adicionado à água do mar,
para que o Mg(OH) 2(s) se precipite, permanecendo os
íons Ca2+(aq) na fase aquosa. Após precipitação do cloreto de
magnésio, MgCl2(s), produto final desse processo, esse sal
é utilizado para produzir magnésio por eletrólise.
A partir da análise desse fluxograma e das informações do
texto, é correto afirmar:

No processo Dow, de extração de magnésio, da água do mar, sob a forma de íons Mg2+(aq), representado pelo fluxograma, hidróxido de cálcio, Ca(OH)2(aq), é adicionado à água do mar, para que o Mg(OH) 2(s) se precipite, permanecendo os íons Ca2+(aq) na fase aquosa. Após precipitação do cloreto de magnésio, MgCl2(s), produto final desse processo, esse sal é utilizado para produzir magnésio por eletrólise.
A partir da análise desse fluxograma e das informações do
texto, é correto afirmar:
A solubilidade desse sal, a 25 °C, é de 2,0
mg/L.
O cloreto de amônio, NH4Cl, é uma substância química sólida de cor branca, utilizada pelos egípcios, na antiguidade, como adubo.
O fertilizante era obtido a partir de esterco de camelos.Considerando-se essas informações, é correto afirmar
 íon no cloreto de amônio é uma espécie química de forma geométrica piramidal.
íon no cloreto de amônio é uma espécie química de forma geométrica piramidal.
Sabe-se que os íons bário (Ba2+) são extremamente tóxicos ao organismo humano. Porém os médicos
utilizam uma suspensão de sulfato de bário (BaSO4), um sal pouquíssimo solúvel em água, como
contrastante radiológico. Normalmente, a suspensão é preparada em uma solução de sulfato de potássio
(K2SO4), um sal bastante solúvel em água.
BaSO4 (s) → Ba2+(aq) + SO4
2-
(aq)
K2SO4 (s) → 2K+
(aq) + SO4
2-
(aq)
A função do sulfato de potássio nessa situação é:
O estômago produz ácidos para ajudar na digestão dos
alimentos. Esses ácidos, os quais incluem ácido clorídrico,
contém aproximadamente 0,1 mol de íons H+
por litro de
solução. O estômago e o trato digestivo são normalmente
protegidos dos efeitos corrosivos do ácido estomacal por
um revestimento mucoso.
Em relação às reações inorgânicas em solução, é
INCORRETO afirmar que:
Uma consequência importante da solubilidade envolve
o uso de uma suspensão de sulfato de bário para
melhorar a visibilidade dos exames de raios-X do trato
gastrointestinal. A solubilidade muito baixa do sulfato
de bário em solução aquosa, que contém íons tóxicos
de Ba2+, torna segura a ingestão deste composto.
Sabendo que o produto de solubilidade do sulfato de
bário, BaSO4, é definido por
BaSO4(s)  Ba2+(aq) + SO4
2−(aq) Kps = 1,0 . 10−10
Ba2+(aq) + SO4
2−(aq) Kps = 1,0 . 10−10
calcule a solubilidade molar deste sal.
 Ba2+(aq) + SO4
2−(aq) Kps = 1,0 . 10−10
Ba2+(aq) + SO4
2−(aq) Kps = 1,0 . 10−10