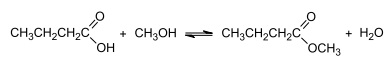(CoCl4)
2−
(s) + 6H2O(l) [Co(H2O)6]
2+(aq) + 4Cl−
(aq) ΔHº=−504kJ
As pequenas esferas azuis de sílica gel utilizadas como
desumidificadores no transporte e na proteção de aparelhos
eletroeletrônicos, em atmosfera úmida, absorve água do
ambiente tornando-se cor de rosa. Ao serem aquecidas em
uma estufa, voltam a ter a cor azul inicial de acordo com o
sistema em equilíbrio químico representado pela equação
química.
A análise desse sistema em equilíbrio químico e das
informações referidas no texto permite afirmar:
(CoCl4) 2− (s) + 6H2O(l) [Co(H2O)6] 2+(aq) + 4Cl− (aq) ΔHº=−504kJ
As pequenas esferas azuis de sílica gel utilizadas como desumidificadores no transporte e na proteção de aparelhos eletroeletrônicos, em atmosfera úmida, absorve água do ambiente tornando-se cor de rosa. Ao serem aquecidas em uma estufa, voltam a ter a cor azul inicial de acordo com o sistema em equilíbrio químico representado pela equação química.
A análise desse sistema em equilíbrio químico e das
informações referidas no texto permite afirmar:




 CH
CH