Questõessobre Propriedades Físicas dos Compostos Orgânicos: Polaridade das Ligações e Moléculas, Forças Intermoleculares, Ponto de Fusão e Ponto de Ebulição, Solubilização das Substâncias Orgânicas.
Os pontos de fusão e de ebulição das substâncias são influenciados pelas forças das ligações entre os átomos que as
compõem e por interações intermoleculares. O metano tem ponto de ebulição muito baixo (-161°C), sendo, por isso, um
gás na temperatura ambiente. O metano está no estado gasoso na CNTP por
Um dos materiais mais utilizados na fabricação de sacolas esportivas é o náilon. Esse polímero é produzido a partir
do ciclo-hexano (pertencente à classe dos ciclanos), que é um solvente e removedor de materiais apolares como as tintas
e vernizes. Os ciclanos existem, em quantidades maiores ou menores, no petróleo de várias regiões do mundo.
A partir do texto e de seus conhecimentos de química, assinale a alternativa correta.
Têm-se duas substâncias X e Y, sendo a primeira
orgânica e a segunda inorgânica. Com relação a X e Y,
afirma-se que:
I a maioria das reações de X são mais rápidas do
que as de Y;
II X é solúvel em solventes apolares e Y em solventes
polares;
III X provavelmente tem isômeros; Y não os tem.
Assinale a alternativa que apresenta as afirmações
corretas em relação a X e Y.
Têm-se duas substâncias X e Y, sendo a primeira orgânica e a segunda inorgânica. Com relação a X e Y, afirma-se que:
I a maioria das reações de X são mais rápidas do que as de Y;
II X é solúvel em solventes apolares e Y em solventes polares;
III X provavelmente tem isômeros; Y não os tem.
Assinale a alternativa que apresenta as afirmações
corretas em relação a X e Y.
Considerando as informações apresentadas no texto e no
quadro, a principal razão para a diferença de coloração
descrita é que a fração oleosa
Note e adote:
Massas molares (g/mol):
Licopeno = 537; betanina = 551.

Considerando o texto e a estrutura do polietileno apresentados acima, julgue o próximo item.
Na água, a solubilidade do poliacetileno é elevada porque esse
polímero forma facilmente ligações de hidrogênio com esse
solvente.
Considerando o texto e a estrutura do polietileno apresentados acima, julgue o próximo item.
Na água, a solubilidade do poliacetileno é elevada porque esse
polímero forma facilmente ligações de hidrogênio com esse
solvente.
Nos polímeros condutores, a flexibilidade e a facilidade de processamento típicas dos polímeros são combinadas com propriedades ópticas e eletrônicas de metais e semicondutores. Nesse tipo de polímero, a presença de ligações duplas alternadas faz que os elétrons π estejam deslocalizados devido à ressonância, efeito responsável pela condutividade elétrica do material. O poliacetileno, polímero de adição do acetileno (etino), foi o primeiro polímero condutor sintetizado.

Com base nessa situação e considerando que os comportamentos
das soluções sejam ideais e que os polímeros sejam estáveis na
temperatura de ebulição do solvente empregado em suas sínteses,
julgue o item.
O ponto de fusão do polímero A é mais elevado que o do
polímero B.
Com base nessa situação e considerando que os comportamentos das soluções sejam ideais e que os polímeros sejam estáveis na temperatura de ebulição do solvente empregado em suas sínteses, julgue o item.
O ponto de fusão do polímero A é mais elevado que o do
polímero B.

A partir da polimerização de determinado monômero,
realizada em solução com duas diferentes condições reacionais,
chegou-se a polímeros com diferentes distribuições de
massas molares, conforme ilustrado na figura acima. Ao final
dos procedimentos de síntese, as duas soluções obtidas —
uma contendo o polímero A (solução I) e outra, o polímero B
(solução II) — tinham concentrações iguais, em g/L.
Os hidrocarbonetos são moléculas orgânicas com uma série de aplicações industriais. Por exemplo, eles estão
presentes em grande quantidade nas diversas frações do petróleo e normalmente são separados por destilação
fracionada, com base em suas temperaturas de ebulição. O quadro apresenta as principais frações obtidas na
destilação do petróleo em diferentes faixas de temperaturas.

Na fração 4, a separação dos compostos ocorre em temperaturas mais elevadas porque
Os hidrocarbonetos são moléculas orgânicas com uma série de aplicações industriais. Por exemplo, eles estão presentes em grande quantidade nas diversas frações do petróleo e normalmente são separados por destilação fracionada, com base em suas temperaturas de ebulição. O quadro apresenta as principais frações obtidas na destilação do petróleo em diferentes faixas de temperaturas.

Na fração 4, a separação dos compostos ocorre em temperaturas mais elevadas porque
O bisfenol A é uma substância empregada na síntese de policarbonato e resinas epóxi, com aplicações que vão
desde computadores e eletrodomésticos até revestimentos para latas de alimentos e bebidas. Estudos apontam
que a substância, por possuir similaridade com um hormônio feminino da tireoide, atua como um interferente
endócrino. No Brasil, desde 2012 é proibida a venda de mamadeiras ou outros utensílios que contenham bisfenol
A. O 2,2-difenilpropano, de estrutura similar ao bisfenol A, é um hidrocarboneto com grau de toxicidade ainda
maior que o bisfenol A. As fórmulas estruturais dessas substâncias são apresentadas a seguir.
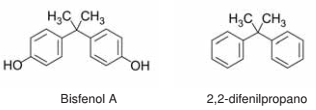
Com base nas propriedades físico-químicas dessas substâncias, considere as afirmativas a seguir.
I. A solubilidade do bisfenol A em solução alcalina é maior que em água pura.
II. Ligações de hidrogênio e interações π − π são forças intermoleculares que atuam entre moléculas de bisfenol A.
III. A solubilidade do 2,2-difenilpropano em água é maior do que em hexano.
IV. O ponto de fusão do 2,2-difenilpropano é maior que do bisfenol A.
Assinale a alternativa correta.
O bisfenol A é uma substância empregada na síntese de policarbonato e resinas epóxi, com aplicações que vão desde computadores e eletrodomésticos até revestimentos para latas de alimentos e bebidas. Estudos apontam que a substância, por possuir similaridade com um hormônio feminino da tireoide, atua como um interferente endócrino. No Brasil, desde 2012 é proibida a venda de mamadeiras ou outros utensílios que contenham bisfenol A. O 2,2-difenilpropano, de estrutura similar ao bisfenol A, é um hidrocarboneto com grau de toxicidade ainda maior que o bisfenol A. As fórmulas estruturais dessas substâncias são apresentadas a seguir.

Com base nas propriedades físico-químicas dessas substâncias, considere as afirmativas a seguir.
I. A solubilidade do bisfenol A em solução alcalina é maior que em água pura.
II. Ligações de hidrogênio e interações π − π são forças intermoleculares que atuam entre moléculas de bisfenol A.
III. A solubilidade do 2,2-difenilpropano em água é maior do que em hexano.
IV. O ponto de fusão do 2,2-difenilpropano é maior que do bisfenol A.
Assinale a alternativa correta.
Em 2017, a ANVISA aprovou a administração de um medicamento antirretroviral composto pela combinação das
substâncias entricitabina (FTC) e fumarato (molécula contendo ácido carboxílico como função orgânica) de tenofovir desoproxila (TDF) para pessoas com alto risco de infecção pelo vírus HIV. O medicamento apresenta Profilaxia
Pré-Exposição (PrEP), ou seja, evita que uma pessoa que não tem HIV adquira a infecção quando se expõe ao
vírus.
As estruturas químicas da FTC e do TDF são apresentada

Dados:
Massa molar da FTC = 247,24 g mol−1
Massa molar do TDF = 635,52 g mol−1
Sabe-se que a solubilidade em água a 25 °C da FTC é 13,4 mg L−1 e do TDF é 112,0 mg mL−1 e que a constante
de ionização da FTC é de 5,12 x 10−15, cujo hidrogênio ácido é aquele pertencente à hidroxila.
Com base nas estruturas químicas e nas informações apresentadas sobre as moléculas, assinale a alternativa
correta.
Em 2017, a ANVISA aprovou a administração de um medicamento antirretroviral composto pela combinação das substâncias entricitabina (FTC) e fumarato (molécula contendo ácido carboxílico como função orgânica) de tenofovir desoproxila (TDF) para pessoas com alto risco de infecção pelo vírus HIV. O medicamento apresenta Profilaxia Pré-Exposição (PrEP), ou seja, evita que uma pessoa que não tem HIV adquira a infecção quando se expõe ao vírus.
As estruturas químicas da FTC e do TDF são apresentada

Dados:
Massa molar da FTC = 247,24 g mol−1
Massa molar do TDF = 635,52 g mol−1
Sabe-se que a solubilidade em água a 25 °C da FTC é 13,4 mg L−1 e do TDF é 112,0 mg mL−1 e que a constante de ionização da FTC é de 5,12 x 10−15, cujo hidrogênio ácido é aquele pertencente à hidroxila.
Com base nas estruturas químicas e nas informações apresentadas sobre as moléculas, assinale a alternativa
correta.
Em um experimento, determinadas massas de ácido maleico e
acetona foram misturadas a 0 °C, preparando‐se duas misturas
idênticas. Uma delas (X) foi resfriada a ‐78 °C, enquanto a outra
(M) foi mantida a 0 °C. A seguir, ambas as misturas (M e X)
foram filtradas, resultando nas misturas N e Y. Finalmente, um
dos componentes de cada mistura foi totalmente retirado por
destilação. Os recipientes (marcados pelas letras O e Z)
representam o que restou de cada mistura após a destilação.
Nas figuras, as moléculas de cada componente estão
representadas por retângulos ou triângulos.

Tanto no recipiente M como no recipiente X, estão
representadas soluções ___I___ de ___II___, cuja solubilidade
___III___ com a diminuição da temperatura. A uma
determinada temperatura, as concentrações em M e N e em X
e Y são ___IV___. Em diferentes instantes, as moléculas
representadas por um retângulo pertencem a um composto
que pode estar ___V___ ou no estado ___VI___.
As lacunas que correspondem aos números de I a VI devem ser
corretamente preenchidas por:

Em um experimento, determinadas massas de ácido maleico e acetona foram misturadas a 0 °C, preparando‐se duas misturas idênticas. Uma delas (X) foi resfriada a ‐78 °C, enquanto a outra (M) foi mantida a 0 °C. A seguir, ambas as misturas (M e X) foram filtradas, resultando nas misturas N e Y. Finalmente, um dos componentes de cada mistura foi totalmente retirado por destilação. Os recipientes (marcados pelas letras O e Z) representam o que restou de cada mistura após a destilação. Nas figuras, as moléculas de cada componente estão representadas por retângulos ou triângulos.

Tanto no recipiente M como no recipiente X, estão representadas soluções ___I___ de ___II___, cuja solubilidade ___III___ com a diminuição da temperatura. A uma determinada temperatura, as concentrações em M e N e em X e Y são ___IV___. Em diferentes instantes, as moléculas representadas por um retângulo pertencem a um composto que pode estar ___V___ ou no estado ___VI___.
As lacunas que correspondem aos números de I a VI devem ser corretamente preenchidas por:

I- saturadas
II- acetona
III- aumenta
IV- diferentes
V- sólido
VI- líquido
I- homogêneas
II- ácido maleico
III- diminui
IV- iguais
V- dissolvido
VI- líquido
I- saturadas
II- ácido maleico
III- diminui
IV- iguais
V- dissolvido
VI- sólido
I- heterogêneas
II- acetona
III- aumenta
IV- diferentes
V- sólido
VI- sólido
I- saturadas
II- ácido maleico
III- diminui
IV- iguais
V- sólido
VI- líquido
O gráfico a seguir indica a temperatura de ebulição de
bromoalcanos (CnH2n+1Br) para diferentes tamanhos de cadeia
carbônica.

Considerando as propriedades periódicas dos halogênios, a
alternativa que descreve adequadamente o comportamento
expresso no gráfico de temperaturas de ebulição versus
tamanho de cadeia carbônica para CnH2n+1F ( )
e CnH2n+1I (•) é:
)
e CnH2n+1I (•) é:
Note e adote:
P.E. = ponto de ebulição
O gráfico a seguir indica a temperatura de ebulição de bromoalcanos (CnH2n+1Br) para diferentes tamanhos de cadeia carbônica.

Considerando as propriedades periódicas dos halogênios, a
alternativa que descreve adequadamente o comportamento
expresso no gráfico de temperaturas de ebulição versus
tamanho de cadeia carbônica para CnH2n+1F ( )
e CnH2n+1I (•) é:
)
e CnH2n+1I (•) é:
Note e adote:
P.E. = ponto de ebulição





Leia o texto a seguir.
Durante a vida e após a morte, o corpo humano serve
de abrigo e alimento para diversos tipos de bactérias que
produzem compostos químicos, como a cadaverina e a
putrescina. Essas moléculas se formam da decomposição
de proteínas, sendo responsáveis, em parte, pelo
cheiro de fluidos corporais nos organismos vivos e que
também estão associadas ao mau odor característico dos
cadáveres no processo de putrefação.
(Adaptado de: <http://qnint.sbq.org.br/novo/index.php?hash= molecula.248>. Acesso em: 22 maio 2017.)
As fórmulas estruturais da cadaverina e da putrescina
são apresentadas a seguir.

Com base nos conhecimentos sobre funções orgânicas
e propriedades de compostos orgânicos, assinale
a alternativa que apresenta, corretamente, a característica
dessas moléculas.

Umectantes são aditivos que entram na fabricação de
bolos, panetones, rocamboles etc. A finalidade é evitar que
a massa resseque. Para tanto, um umectante deve possuir
alta afinidade pela água. Indique qual das substâncias
abaixo é usada como umectante:
O soro caseiro, que serve para combater a desidratação causada por diarreia ou vômito, é
uma solução aquosa contendo sal de cozinha (NaCl) e açúcar (C12H22O11). Ele pode ser
feito misturando-se 3,5g de sal de cozinha e 20g de açúcar em 1L de água. Em relação ao
soro caseiro, assinale a alternativa CORRETA:
Dados:
Coeficiente de Solubilidade do NaCl: 36g NaCl/100mL de água a 20°C; Coeficiente de
Solubilidade do C12H22O11: 33g C12H22O11/100mL de água a 20°C.
O soro caseiro, que serve para combater a desidratação causada por diarreia ou vômito, é uma solução aquosa contendo sal de cozinha (NaCl) e açúcar (C12H22O11). Ele pode ser feito misturando-se 3,5g de sal de cozinha e 20g de açúcar em 1L de água. Em relação ao soro caseiro, assinale a alternativa CORRETA:
Dados:
Coeficiente de Solubilidade do NaCl: 36g NaCl/100mL de água a 20°C; Coeficiente de Solubilidade do C12H22O11: 33g C12H22O11/100mL de água a 20°C.
Um químico que trabalha em um laboratório de pesquisa recebeu a estrutura molecular de
alguns polímeros como demonstrados abaixo:
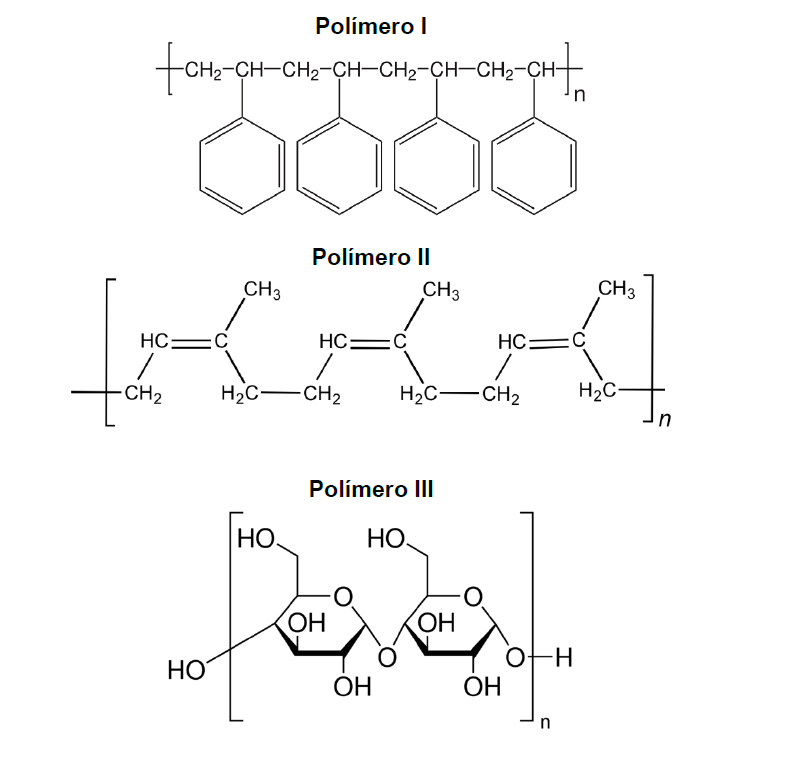
Após analisar as estruturas dessas substâncias, o químico concluiu que os polímeros
I, II e III são solúveis, respectivamente, nos seguintes solventes:
Um químico que trabalha em um laboratório de pesquisa recebeu a estrutura molecular de alguns polímeros como demonstrados abaixo:

Após analisar as estruturas dessas substâncias, o químico concluiu que os polímeros
I, II e III são solúveis, respectivamente, nos seguintes solventes:
O ácido cítrico é um sólido branco e cristalino,
muito utilizado na indústria alimentícia e de
bebidas, e sua estrutura é representada
abaixo.
 Considere as seguintes afirmações sobre esse
composto.
Considere as seguintes afirmações sobre esse
composto.
I - Apresenta boa solubilidade em água e em
soluções alcalinas.
II - Possui apenas um carbono quiral em sua
estrutura química.
III- É um ácido graxo tricarboxílico.
Quais estão corretas?

Assinale a alterantiva que preenche
corretamente as lacunas do enunciado abaixo,
na ordem em que aparecem.
O cis-1,2-dicloroeteno é uma molécula ........ ,
e o seu isômero trans apresenta ........ ponto
de ebulição por ser uma molécula ........ .
Assinale a alterantiva que preenche corretamente as lacunas do enunciado abaixo, na ordem em que aparecem.
O cis-1,2-dicloroeteno é uma molécula ........ , e o seu isômero trans apresenta ........ ponto de ebulição por ser uma molécula ........ .
Vários materiais, quando queimados, podem levar
à formação de dioxinas, um composto do grupo dos
organoclorados. Mesmo quando a queima ocorre em
incineradores, há liberação de substâncias derivadas
da dioxina no meio ambiente. Tais compostos são
produzidos em baixas concentrações, como resíduos da
queima de matéria orgânica em presença de produtos
que contenham cloro. Como consequência de seu
amplo espalhamento no meio ambiente, bem como
de suas propriedades estruturais, as dioxinas sofrem
magnificação trófica na cadeia alimentar. Mais de 90%
da exposição humana às dioxinas é atribuída aos
alimentos contaminados ingeridos. A estrutura típica de
uma dioxina está apresentada a seguir:

A molécula do 2,3,7,8 - TCDD é popularmente conhecida
pelo nome ‘dioxina’, sendo a mais tóxica dos 75 isômeros
de compostos clorados de dibenzo-p-dioxina existentes.
FADINI, P S; FADINI, A. A. B. Lixo: desafios e compromissos. Cadernos Temáticos de
Química Nova na Escola, São Paulo, n. 1, maio 2001 (adaptado).
Com base no texto e na estrutura apresentada, as
propriedades químicas das dioxinas que permitem sua
bioacumulação nos organismos estão relacionadas ao
seu caráter

Um método para determinação do teor de etanol na
gasolina consiste em misturar volumes conhecidos de
água e de gasolina em um frasco específico. Após agitar
o frasco e aguardar um período de tempo, medem-se os
volumes das duas fases imiscíveis que são obtidas: uma
orgânica e outra aquosa. O etanol, antes miscível com a
gasolina, encontra-se agora miscível com a água.
Para explicar o comportamento do etanol antes e depois
da adição de água, é necessário conhecer
Um método para determinação do teor de etanol na gasolina consiste em misturar volumes conhecidos de água e de gasolina em um frasco específico. Após agitar o frasco e aguardar um período de tempo, medem-se os volumes das duas fases imiscíveis que são obtidas: uma orgânica e outra aquosa. O etanol, antes miscível com a gasolina, encontra-se agora miscível com a água.
Para explicar o comportamento do etanol antes e depois da adição de água, é necessário conhecer