O CHOCOLATE E A SAÚDE DO CORAÇÃO
O chocolate tem efeitos benéficos para o coração.
Cientistas da Universidade de Linkoping, na Suécia,
descobriram que a versão amarga (rica em cacau) inibe uma
enzima no organismo conhecida por elevar a pressão arterial.
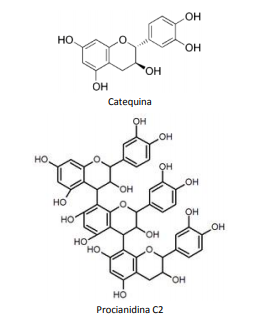
O resultado positivo é atribuído às catequinas e às
procianidinas, antioxidantes encontrados na iguaria.
Disponível em: <https://saude.terra.com.br/nutricao/chocolate-faz-bem-para-a-saude-confira-10-beneficios,a2f98c3d10f27310V gnCLD 10000bbcceb0aRCRD.html>.
Acesso em: 22 de julho de 2016.
Disponível em: <Imagens do google.com.br>.
Acesso em: 22 de julho de 2016.
A análise das estruturas permite inferir que a catequina e
a procianidina C2 são
O CHOCOLATE E A SAÚDE DO CORAÇÃO
O chocolate tem efeitos benéficos para o coração. Cientistas da Universidade de Linkoping, na Suécia, descobriram que a versão amarga (rica em cacau) inibe uma enzima no organismo conhecida por elevar a pressão arterial. O resultado positivo é atribuído às catequinas e às procianidinas, antioxidantes encontrados na iguaria.
Disponível em: <https://saude.terra.com.br/nutricao/chocolate-faz-bem-para-a-saude-confira-10-beneficios,a2f98c3d10f27310V gnCLD 10000bbcceb0aRCRD.html>. Acesso em: 22 de julho de 2016.

Disponível em: <Imagens do google.com.br>.
Acesso em: 22 de julho de 2016.
A análise das estruturas permite inferir que a catequina e
a procianidina C2 são

























