A calagem é uma prática de manejo do solo que consiste
na utilização de calcário para proporcionar às plantas um
ambiente de crescimento radicular adequado. Isso diminui
a atividade de elementos potencialmente tóxicos em
elevadas concentrações (Al e Mn) e favorece a
disponibilidade de elementos essenciais (N, P e K) no solo.
O gráfico a seguir apresenta o grau de disponibilidade de
diversos elementos de acordo com o pH do solo.
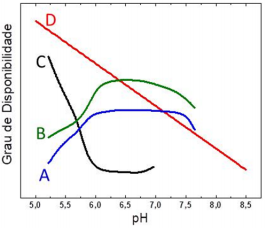
Considerando essas informações e os conhecimentos de
química, é correto afirmar que a calagem atua em solos








