Questõessobre Equilíbrio Químico
Para estudar equilíbrio químico de íons Co2+ em solução, uma
turma de estudantes realizou uma série de experimentos
explorando a seguinte reação:

Nesse equilíbrio, o composto de cobalto com água,
[Co(H2O)6]2+(aq), apresenta coloração vermelha, enquanto o
composto com cloretos, [CoCl4]2-(aq), possui coloração azul.
Para verificar o efeito de ânions de diferentes sais nessa
mudança de cor, 7 ensaios diferentes foram realizados. Aos
tubos contendo apenas alguns mL de uma solução de nitrato de
cobalto II, de coloração vermelha, foram adicionadas pequenas
quantidades de diferentes sais em cada tubo, como
apresentado na tabela, com exceção do ensaio 1, no qual
nenhum sal foi adicionado.
Após agitação, os tubos foram deixados em repouso por um
tempo, e a cor final foi observada.

A alternativa que representa a cor final observada nos ensaios
5, 6 e 7, respectivamente, é:
Note e adote:
Solubilidade dos sais em g/100 mL de água a 20 °C
AgCℓ 1,9 x 10-4 NaCℓ 35,9
CuCℓ 9,9 x 10-3 Na2SO4 13,9
KCℓ 34,2 K2SO4 11,1
Para estudar equilíbrio químico de íons Co2+ em solução, uma turma de estudantes realizou uma série de experimentos explorando a seguinte reação:

Nesse equilíbrio, o composto de cobalto com água, [Co(H2O)6]2+(aq), apresenta coloração vermelha, enquanto o composto com cloretos, [CoCl4]2-(aq), possui coloração azul.
Para verificar o efeito de ânions de diferentes sais nessa mudança de cor, 7 ensaios diferentes foram realizados. Aos tubos contendo apenas alguns mL de uma solução de nitrato de cobalto II, de coloração vermelha, foram adicionadas pequenas quantidades de diferentes sais em cada tubo, como apresentado na tabela, com exceção do ensaio 1, no qual nenhum sal foi adicionado.
Após agitação, os tubos foram deixados em repouso por um tempo, e a cor final foi observada.

A alternativa que representa a cor final observada nos ensaios 5, 6 e 7, respectivamente, é:
Note e adote:
Solubilidade dos sais em g/100 mL de água a 20 °C
AgCℓ 1,9 x 10-4 NaCℓ 35,9
CuCℓ 9,9 x 10-3 Na2SO4 13,9
KCℓ 34,2 K2SO4 11,1
Cor final obtida no:
Ensaio 5 Adição de K2S04 - Azul
Ensaio 6 Adição de AgCℓ - Azul
Ensaio 7 Adição de NaCℓ - Vermelha
Cor final obtida no:
Ensaio 5 Adição de K2S04 - Azul
Ensaio 6 Adição de AgCℓ - Vermelha
Ensaio 7 Adição de NaCℓ - Azul
Cor final obtida no:
Ensaio 5 Adição de K2S04 - Vermelha
Ensaio 6 Adição de AgCℓ - Azul
Ensaio 7 Adição de NaCℓ - Azul
Cor final obtida no:
Ensaio 5 Adição de K2S04 - Vermelha
Ensaio 6 Adição de AgCℓ - Vermelha
Ensaio 7 Adição de NaCℓ - Azul
Cor final obtida no:
Ensaio 5 Adição de K2S04 - Vermelha
Ensaio 6 Adição de AgCℓ - Azul
Ensaio 7 Adição de NaCℓ - Vermelha
A agricultura de frutas cítricas requer que o valor
do pH do solo esteja na faixa ideal entre 5,8 e 6,0. Em
uma fazenda, o valor do pH do solo é 4,6. O agricultor
resolveu testar três produtos de correção de pH em
diferentes áreas da fazenda. O primeiro produto possui
íons sulfato e amônio, o segundo produto possui íons
carbonato e cálcio e o terceiro produto possui íons
sulfato e sódio.
O íon que vai produzir o efeito desejado de correção no
valor do pH é o
Considere uma amostra de lama, coletada no rio Doce, em que se pode ter o equilíbrio químico do carbonato de chumbo II,
a25°C, representado pela equação.
PbCO3(s) ⥋ Pb2 +(aq) + CO3
2 –(aq)
A concentração de íons carbonato, presentes nesse equilíbrio, é
Dado:
Produto de Solubilidade do PbCO3, a 25 °C: Kps = 7,4 · 10–14
O carbonato de cálcio é um sal
inorgânico, pouco solúvel em água. Sendo o
principal componente do calcário e o principal
constituinte de esqueletos e conchas de animais
marinhos. Qual o produto de solubilidade de
uma amostra de carbonato de cálcio que
apresenta uma solubilidade de 0,015 g/l a 20ºC.


Um aluno do curso de
química em uma aula prática de Química Geral, precisa preparar uma solução de hidróxido de
potássio de pH = 12 a 25ºC. qual a massa de
KOH que ele precisa dissolver em 200 mL de
água para obter o pH desejado?

É possível identificar adulterantes do leite de vaca por meio da adição do indicador azul de
bromofenol. A presença de agentes oxidantes provoca a descoloração do indicador, mantendo
a cor branca na amostra, característica do leite. Substâncias redutoras presentes no leite
reagem com o azul de bromofenol, gerando a cor verde. A diminuição do valor de pH do leite
torna o indicador amarelo. Em pH mais elevado, o indicador adquire a cor violeta e, em meio
neutro, a cor azul. Considere que um lote industrial de leite em embalagem longa vida foi
adulterado com excesso de soda cáustica.
Em uma inspeção sanitária do lote adulterado, qual será a cor apresentada pelo leite após
adição do indicador azul de bromofenol?
É possível identificar adulterantes do leite de vaca por meio da adição do indicador azul de bromofenol. A presença de agentes oxidantes provoca a descoloração do indicador, mantendo a cor branca na amostra, característica do leite. Substâncias redutoras presentes no leite reagem com o azul de bromofenol, gerando a cor verde. A diminuição do valor de pH do leite torna o indicador amarelo. Em pH mais elevado, o indicador adquire a cor violeta e, em meio neutro, a cor azul. Considere que um lote industrial de leite em embalagem longa vida foi adulterado com excesso de soda cáustica.
Em uma inspeção sanitária do lote adulterado, qual será a cor apresentada pelo leite após
adição do indicador azul de bromofenol?
O reagente conhecido como Kastle-Meyer é muito utilizado por investigadores criminais
para detectar a presença de sangue. Trata-se de uma solução aquosa incolor, preparada com
zinco metálico, hidróxido de sódio (Reação 1) e indicador (Reação 2). Essa solução, quando
em contato com a hemoglobina contida no sangue e na presença de água oxigenada (Reação
3), passa de incolor para vermelha, indicando a presença de sangue no local, conforme as
reações descritas.

DIAS FILHO, C. R.; ANTEDOMENICO, E. A perícia criminal e a interdisciplinaridade no ensino de ciências naturais.
Química Nova na Escola, n. 2, maio 2010 (adaptado).
A mudança de coloração que indica a presença de sangue ocorre por causa da reação do
indicador com o(a)

A solução aquosa de anilina é básica devido à ocorrência do
equilíbrio:

Sabe-se que Kb
≈ 4 × 10–10 a 25 ºC e que o valor de pH de
uma solução aquosa saturada de anilina a 25 ºC é próximo
de 9. Com base nessas informações e sabendo que Kw nessa
temperatura é igual a 1 × 10–14, a concentração aproximada
da solução saturada de anilina a 25 ºC é

Uma amostra de água mineral natural a 25 °C foi testada com
três indicadores ácido-base. Os resultados desse teste estão
indicados na última coluna da tabela.

Analisando as informações da tabela e sabendo que o
produto iônico da água a 25 °C, Kw, é igual a 1 × 10−14, a
concentração de íons OH− (aq) nessa água mineral, em
mol/L, está entre
Uma amostra de água mineral natural a 25 °C foi testada com três indicadores ácido-base. Os resultados desse teste estão indicados na última coluna da tabela.

Analisando as informações da tabela e sabendo que o
produto iônico da água a 25 °C, Kw, é igual a 1 × 10−14, a
concentração de íons OH− (aq) nessa água mineral, em
mol/L, está entre
Para garantir que produtos eletrônicos estejam
armazenados de forma adequada antes da venda,
algumas empresas utilizam cartões indicadores de
umidade nas embalagens desses produtos. Alguns
desses cartões contêm um sal de cobalto que
muda de cor em presença de água, de acordo com
a equação química:
CoCI2(s) + 6 H2O (g) ⇌ CoCI2 • 6H2O (s) ΔH<0
(azul) (rosa)
Como você procederia para reutilizar, num curto
intervalo de tempo, um cartão que já estivesse com a
coloração rosa?
Para garantir que produtos eletrônicos estejam armazenados de forma adequada antes da venda, algumas empresas utilizam cartões indicadores de umidade nas embalagens desses produtos. Alguns desses cartões contêm um sal de cobalto que muda de cor em presença de água, de acordo com a equação química:
CoCI2(s) + 6 H2O (g) ⇌ CoCI2 • 6H2O (s) ΔH<0
(azul) (rosa)
Como você procederia para reutilizar, num curto intervalo de tempo, um cartão que já estivesse com a coloração rosa?
Crime no Museu! Uma estatueta em bronze, constituída por 90% de cobre e 10% de alumínio, foi roubada. Depois
de alguns dias, uma estatueta, com características semelhantes foi encontrada, aos pedaços, em uma lixeira. Foi
realizada uma análise para confirmar sua autenticidade, pois a composição desta estatueta poderia ser de latão,
constituída de 90% de cobre e 10% de zinco. Primeiramente, massas de 0,50 g retiradas dos pedaços encontrados
foram dissolvidas em HNO3 5,0 mol L−1, formando íons em solução. Em seguida, alíquotas dessa solução ácida
foram alcalinizadas com solução de NaOH para a formação de precipitados azul e branco visualmente distinguíveis
e, na sequência, foram adicionadas soluções aquosas de NH4Cl. As equações químicas das reações que podem
ocorrer com a adição dos reagentes são apresentadas a seguir:

Com base no texto e nas equações químicas, assinale a alternativa que apresenta, corretamente, o resultado
experimental que comprova que a estatueta encontrada na lixeira é de bronze.

Um técnico preparou 420g de uma solução saturada de nitrato de potássio (KNO3, dissolvida em água) em um béquer a uma temperatura de 60ºC. Depois deixou a solução esfriar até uma temperatura de 40ºC, verificando a presença de um precipitado.
A massa aproximada desse precipitado é:
(desconsidere a massa de água presente no precipitado)

Um técnico preparou 420g de uma solução saturada de nitrato de potássio (KNO3, dissolvida em água) em um béquer a uma temperatura de 60ºC. Depois deixou a solução esfriar até uma temperatura de 40ºC, verificando a presença de um precipitado.
A massa aproximada desse precipitado é:
(desconsidere a massa de água presente no precipitado)

As substâncias nitrogenadas desempenham importante papel em nossa sociedade. Dentre as de maior importância estão a amônia e o ácido nítrico, usadas na fabricação do náilon e do poliuretano. A conversão de NH3 em NO com o uso de catalisador é o primeiro passo para a fabricação industrial do ácido nítrico e a rota industrial para a obtenção de substâncias oxigenadas do nitrogênio. A reação de produção de NO a partir de NH3 é:

Quando a reação atinge o equilíbrio, uma maneira de aumentar a produção de NO(g) é aumentando a(o)
As substâncias nitrogenadas desempenham importante papel em nossa sociedade. Dentre as de maior importância estão a amônia e o ácido nítrico, usadas na fabricação do náilon e do poliuretano. A conversão de NH3 em NO com o uso de catalisador é o primeiro passo para a fabricação industrial do ácido nítrico e a rota industrial para a obtenção de substâncias oxigenadas do nitrogênio. A reação de produção de NO a partir de NH3 é:

O pH de uma solução, 0,050 mol/L de um ácido forte,
cuja fórmula química genérica é H2B, foi determinado
experimentalmente, e o valor encontrado foi 1,27.
Esse valor de pH éDado: log 2 = 0,3
DESMINERALIZAÇÃO E MINERALIZAÇÃO
Os dentes sofrem contínuos processos de
desmineralização seguida por remineralização e
restabelecimento da integridade do esmalte dentário
devido ao controle do biofilme dentário (placa bacteriana),
à presença de saliva, entre outros fatores. Quando a hidroxiapatita se dissolve, em um processo chamado
desmineralização, os íons dispersam-se na saliva:
Ca5(PO4)3OH(s) ⇄ 5Ca2+(aq) + 3PO3-4(aq) + OH-(aq)
Sendo os fosfatos de metais alcalino-terrosos
pouco solúveis, essa reação não se dá com grande
extensão no sentido direto. A reação inversa, chamada
mineralização, é a defesa natural do organismo contra a
cárie:
5Ca2+(aq) + 3PO3-4(aq) + OH-(aq) ⇄ Ca5(PO4)3OH(s)
Nos adultos, esses dois processos se dão, aproximadamente,
à mesma velocidade
Disponível em:
https://desmineralizacaod.wordpress.com/2011/06/09/des
mineralizacao-e-mineralizacao-2/.
Acesso em: 16 de agosto de 2015.
Após uma refeição, as bactérias presentes na boca
decompõem parte dos alimentos, produzindo ácidos
orgânicos como o ácido acético e o ácido lático. Portanto,
é pertinente inferir que
DESMINERALIZAÇÃO E MINERALIZAÇÃO
Os dentes sofrem contínuos processos de desmineralização seguida por remineralização e restabelecimento da integridade do esmalte dentário devido ao controle do biofilme dentário (placa bacteriana), à presença de saliva, entre outros fatores. Quando a hidroxiapatita se dissolve, em um processo chamado desmineralização, os íons dispersam-se na saliva:
Ca5(PO4)3OH(s) ⇄ 5Ca2+(aq) + 3PO3-4(aq) + OH-(aq)
Sendo os fosfatos de metais alcalino-terrosos pouco solúveis, essa reação não se dá com grande extensão no sentido direto. A reação inversa, chamada mineralização, é a defesa natural do organismo contra a cárie:
5Ca2+(aq) + 3PO3-4(aq) + OH-(aq) ⇄ Ca5(PO4)3OH(s)
Nos adultos, esses dois processos se dão, aproximadamente, à mesma velocidade
Disponível em: https://desmineralizacaod.wordpress.com/2011/06/09/des mineralizacao-e-mineralizacao-2/. Acesso em: 16 de agosto de 2015.
Após uma refeição, as bactérias presentes na boca
decompõem parte dos alimentos, produzindo ácidos
orgânicos como o ácido acético e o ácido lático. Portanto,
é pertinente inferir que
BICARBONATO DE SÓDIO PARA
COMBATER RESFRIADOS E GRIPES
Pode ajudar a manter um correto equilíbrio no
pH do sangue, o que ajuda a combater e evitar as gripes e
resfriados. Em 1924, o Dr. Volney S. Cheney, um médico
que trabalhou para o serviço de saúde pública nos Estados
Unidos, publicou o artigo “Arm & Hammer Baking Soda
Medical Use” no qual relatou os resultados de alguns
testes usando o bicarbonato de sódio, e o resultado foi
que quem fez o tratamento com esse mágico mineral não
contraiu nenhum resfriado ou gripe. O tratamento para
resfriados, usando bicarbonato de sódio, é muito fácil de
fazer, junte 1/2 colher de chá (0,03 mol) de bicarbonato
de sódio em um copo de água fria (100 mL) e beba em
seguida. Deve-se beber um copo de manhã e outro à
noite até os sintomas do resfriado desaparecerem por
completo.
Disponível em:
http://www.remedios-caseiros.com/remedios/bicarbonatode-sodio.html. Adaptada.
Acesso em: 11 de agosto de 2015.
[Dados: Kw = 1 · 10–14; Ka(H2CO3) = 4,3 · 10–7; √69 ≅ 8,3; 3/4,3 ≅ 0,69; log 8,3 ≅ 0,92]
De acordo com o texto, é pertinente inferir que o pH da
solução de bicarbonato de sódio é, aproximadamente,
BICARBONATO DE SÓDIO PARA
COMBATER RESFRIADOS E GRIPES
Pode ajudar a manter um correto equilíbrio no pH do sangue, o que ajuda a combater e evitar as gripes e resfriados. Em 1924, o Dr. Volney S. Cheney, um médico que trabalhou para o serviço de saúde pública nos Estados Unidos, publicou o artigo “Arm & Hammer Baking Soda Medical Use” no qual relatou os resultados de alguns testes usando o bicarbonato de sódio, e o resultado foi que quem fez o tratamento com esse mágico mineral não contraiu nenhum resfriado ou gripe. O tratamento para resfriados, usando bicarbonato de sódio, é muito fácil de fazer, junte 1/2 colher de chá (0,03 mol) de bicarbonato de sódio em um copo de água fria (100 mL) e beba em seguida. Deve-se beber um copo de manhã e outro à noite até os sintomas do resfriado desaparecerem por completo.
Disponível em: http://www.remedios-caseiros.com/remedios/bicarbonatode-sodio.html. Adaptada. Acesso em: 11 de agosto de 2015.
[Dados: Kw = 1 · 10–14; Ka(H2CO3) = 4,3 · 10–7; √69 ≅ 8,3; 3/4,3 ≅ 0,69; log 8,3 ≅ 0,92]
De acordo com o texto, é pertinente inferir que o pH da solução de bicarbonato de sódio é, aproximadamente,
Observe a curva de titulação de uma solução aquosa de
ácido acético 1 mol/L com solução aquosa de hidróxido de
sódio 1 mol/L.
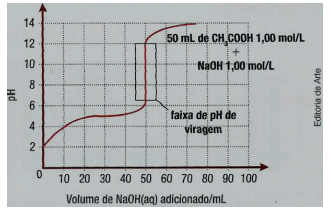
MASTERTON, W. L.; SLOWINSKI, E. J. Química geral superior.
4 ed. Rio de Janeiro: Interamericana, 1978, p. 392.
De acordo com os dados apresentados, é pertinente inferir
que
Observe a curva de titulação de uma solução aquosa de ácido acético 1 mol/L com solução aquosa de hidróxido de sódio 1 mol/L.

MASTERTON, W. L.; SLOWINSKI, E. J. Química geral superior.
4 ed. Rio de Janeiro: Interamericana, 1978, p. 392.
De acordo com os dados apresentados, é pertinente inferir
que
[...] “Solos ácidos, caracterizados por baixos valores
de pH [...], teores insuficientes de cálcio e excesso de
alumínio e/ou manganês, [...] limitam fortemente a
produtividade das culturas, pois impedem absorção plena
dos nutrientes pela plantas.” [...]
Disponível em: http://www.estadao.com.br/noticias/geral,
e-hora-de-aplicar-calcario-no-solo,218382.
Acesso em: 15 de agosto de 2015.
Para tornar o solo adequado a uma boa produtividade,
pode-se inferir que o agricultor deverá usar
[...] “Solos ácidos, caracterizados por baixos valores de pH [...], teores insuficientes de cálcio e excesso de alumínio e/ou manganês, [...] limitam fortemente a produtividade das culturas, pois impedem absorção plena dos nutrientes pela plantas.” [...]
Disponível em: http://www.estadao.com.br/noticias/geral, e-hora-de-aplicar-calcario-no-solo,218382. Acesso em: 15 de agosto de 2015.
Para tornar o solo adequado a uma boa produtividade, pode-se inferir que o agricultor deverá usar
Sob temperatura de 25ºC temos soluções aquosas equimolares (mesma quantidade de matéria) de dois ácidos.
Dado: Ki = constante de ionização.
H2CO3: Ki1 = 4,6.10-7 e Ki2 = 4,4.10-11
H2S2O3: Ki1 = 3,0.10-1 e Ki2 = 2,5.10-2
Assinale a alternativa que contém a ordem crescente de abundância dos ânions correspondente aos ácidos citados acima.
Sob temperatura de 25ºC temos soluções aquosas equimolares (mesma quantidade de matéria) de dois ácidos. Dado: Ki = constante de ionização.
H2CO3: Ki1 = 4,6.10-7 e Ki2 = 4,4.10-11
H2S2O3: Ki1 = 3,0.10-1 e Ki2 = 2,5.10-2
Assinale a alternativa que contém a ordem crescente de abundância dos ânions correspondente aos ácidos citados acima.