Questõessobre Cinética Química
Um antiácido comercial em pastilhas possui, em sua composição, entre outras substâncias, bicarbonato de sódio, carbonato de sódio e ácido cítrico. Ao ser colocada em água, a pastilha dissolve‐se completamente e libera gás carbônico, o que causa a efervescência. Para entender a influência de alguns fatoressobre a velocidade de dissolução da pastilha, adicionou‐ se uma pastilha a cada um dos quatro recipientes descritos na tabela, medindo‐se o tempo até a sua dissolução completa.

Para todos os experimentos, foi usada água mineral da mesma marca. Considere a água com gás como tendo gás carbônico dissolvido.
Com base nessas informações, é correto afirmar que
Um antiácido comercial em pastilhas possui, em sua composição, entre outras substâncias, bicarbonato de sódio, carbonato de sódio e ácido cítrico. Ao ser colocada em água, a pastilha dissolve‐se completamente e libera gás carbônico, o que causa a efervescência. Para entender a influência de alguns fatoressobre a velocidade de dissolução da pastilha, adicionou‐ se uma pastilha a cada um dos quatro recipientes descritos na tabela, medindo‐se o tempo até a sua dissolução completa.

Para todos os experimentos, foi usada água mineral da mesma marca. Considere a água com gás como tendo gás carbônico dissolvido.
Com base nessas informações, é correto afirmar que
De tempos em tempos, o mundo se choca com notícias
sobre o uso de armas químicas em conflitos. O sarin é um
composto organofosforado líquido, insípido, incolor e
inodoro, altamente volátil, que se transforma em gás
quando exposto ao ar, sendo um dos principais alvos
dessas notícias. Em 1955, um projeto confidencial do
exército americano estudou a eficiência de hipoclorito na
eliminação de sarin em ambientes contaminados. A tabela
a seguir mostra alguns resultados obtidos nesse estudo.

Sendo t1/2 o tempo para a concentração do sarin cair à
metade, de acordo com a tabela a reação é mais rápida em

A decomposição anaeróbica da matéria orgânica que
ocorre durante a putrefação de cadáveres produz, dentre
outros gases, o metano (CH4). Na combustão completa
do CH4, na presença de oxigênio (O2), há formação
de água (H2O) e dióxido de carbono (CO2), ambos
gasosos, sendo este último menos prejudicial ao
meio ambiente que o CH4.
Com base nos conhecimentos sobre cinética e considerando
que a reação de combustão do CH4 ocorra
num sistema isolado, atribua V (verdadeiro) ou F (falso)
às afirmativas a seguir.
( ) A adição de um catalisador na mistura aumenta
o rendimento da reação e promove a formação
de outros produtos.
( ) A diminuição do volume ocupado pela mistura
gasosa resulta no aumento da velocidade da reação.
( ) A velocidade de decomposição de CH4 é a metade
da velocidade de formação de H2O.
( ) A velocidade da reação dobra quando as concentrações
de CH4 e O2 forem duplicadas.
( ) A velocidade de formação dos produtos, CO2(g)
e H2O(g), da reação de combustão é a mesma.
Assinale a alternativa que contém, de cima para baixo,
a sequência correta.
A figura a seguir mostra o diagrama de energia da reação A+B→C, ocorrendo via caminho 1 (linha sólida) ou 2 (pontilhado).

Com base no diagrama, analise os itens a seguir:
I) Existe a formação de um intermediário de reação no caminho 2.
II) Apenas um estado de transição (complexo ativado) está presente no caminho 1.
III) A reação deve se processar mais rapidamente, se ocorrer pelo caminho 1.
IV) O caminho 2 pode representar a reação A+B→C,na presença de um catalisador.
Estão corretos os itens:
A figura a seguir mostra o diagrama de energia da reação A+B→C, ocorrendo via caminho 1 (linha sólida) ou 2 (pontilhado).

Com base no diagrama, analise os itens a seguir:
I) Existe a formação de um intermediário de reação no caminho 2.
II) Apenas um estado de transição (complexo ativado) está presente no caminho 1.
III) A reação deve se processar mais rapidamente, se ocorrer pelo caminho 1.
IV) O caminho 2 pode representar a reação A+B→C,na presença de um catalisador.
Estão corretos os itens:
O níquel é empregado na indústria como catalisador de diversas reações, como
na reação de reforma do etileno glicol, que produz hidrogênio a ser utilizado
como combustível. O processo ocorre num tempo muito menor quando é
utilizado 1 g de níquel em uma forma porosa desse material, em comparação à
reação utilizando uma única peça cúbica de 1 g de níquel. Abaixo está
esquematizada a equação de reforma do etileno glicol e ao lado uma imagem de
microscopia eletrônica de uma amostra de níquel na forma porosa.

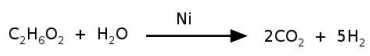
Nas condições mencionadas, a reação de reforma ocorre num tempo menor
quando usado o níquel poroso porque:
O níquel é empregado na indústria como catalisador de diversas reações, como na reação de reforma do etileno glicol, que produz hidrogênio a ser utilizado como combustível. O processo ocorre num tempo muito menor quando é utilizado 1 g de níquel em uma forma porosa desse material, em comparação à reação utilizando uma única peça cúbica de 1 g de níquel. Abaixo está esquematizada a equação de reforma do etileno glicol e ao lado uma imagem de microscopia eletrônica de uma amostra de níquel na forma porosa.


Nas condições mencionadas, a reação de reforma ocorre num tempo menor
quando usado o níquel poroso porque:
O ácido hidrazoico HN3 é um ácido volátil e
tóxico que reage de modo extremamente
explosivo e forma hidrogênio e nitrogênio, de
acordo com a reação abaixo.
2 HN3 → H2 + 3 N2
Sob determinadas condições, a velocidade de
decomposição do HN3 é de 6,0 x 10 –2 mol L – 1
min – 1
Nas mesmas condições, as velocidades de
formação de H2 e de N2 em mol L – 1 min – 1
, são,
respectivamente,
O ácido hidrazoico HN3 é um ácido volátil e tóxico que reage de modo extremamente explosivo e forma hidrogênio e nitrogênio, de acordo com a reação abaixo.
2 HN3 → H2 + 3 N2
Nas mesmas condições, as velocidades de
formação de H2 e de N2 em mol L – 1 min – 1
, são,
respectivamente,
De acordo com a Lei de Hess, a variação de
entalpia de uma reação depende apenas dos
estados inicial e final.
Considere as afirmações abaixo, sobre a Lei
de Hess.
I - A reação reversa de uma reação
endotérmica é sempre exotérmica.
II - A reação de combustão de um açúcar
produzindo CO2 e água terá a mesma
variação de entalpia, caso ocorra em um
calorímetro ou no organismo humano.
III- Um catalisador adequado propicia um
caminho com menor diferença de entalpia
entre reagente e produtos.
Quais estão corretas?
De acordo com a Lei de Hess, a variação de entalpia de uma reação depende apenas dos estados inicial e final.
Considere as afirmações abaixo, sobre a Lei de Hess.
I - A reação reversa de uma reação endotérmica é sempre exotérmica.
II - A reação de combustão de um açúcar produzindo CO2 e água terá a mesma variação de entalpia, caso ocorra em um calorímetro ou no organismo humano.
III- Um catalisador adequado propicia um caminho com menor diferença de entalpia entre reagente e produtos.
Quais estão corretas?
Uma reação química hipotética é representada pela seguinte equação:
A(g) + B(g) → C(g) + D(g) e ocorre em duas etapas:
A(g) → E(g) + D(g) (Etapa lenta)
E(g) + B(g) → C(g) (Etapa rápida)
A lei da velocidade da reação pode ser dada por
Várias indústrias químicas e de alimentos buscam aumentar a velocidade das reações químicas envolvidas
em seus processos para que possam aumentar a produção realizada em um determinado tempo, gerando,
assim, uma maior produção e, consequentemente, um maior lucro. Por esses motivos é que o estudo da
velocidade de uma reação química é importante. A esse respeito, analise as afirmações a seguir.
I. Com a elevação da temperatura a velocidade de uma reação química aumenta.
II. O aumento da concentração dos reagentes diminui a velocidade de uma reação química. III.O uso de catalisadores aumenta a velocidade das reações químicas.
IV.Quanto maior for a superfície de contato, para os sólidos, menor será a velocidade da reação química.
V. A velocidade de uma reação química não depende do aumento da temperatura, do uso de catalisadores
ou do aumento da superfície de contato (no caso de sólidos), apenas depende da natureza dos reagentes
envolvidos.
Estão CORRETAS, apenas, as proposições
Alguns fatores podem alterar a rapidez das reações
químicas. A seguir destacam-se três exemplos no
contexto da preparação e da conservação de alimentos:
1. A maioria dos produtos alimentícios se conserva por
muito mais tempo quando submetidos à refrigeração.
Esse procedimento diminui a rapidez das reações que
contribuem para a degradação de certos alimentos.
2. Um procedimento muito comum utilizado em práticas
de culinária é o corte dos alimentos para acelerar o seu
cozimento, caso não se tenha uma panela de pressão.
3. Na preparação de iogurtes, adicionam-se ao leite
bactérias produtoras de enzimas que aceleram as
reações envolvendo açúcares e proteínas lácteas.
Com base no texto, quais são os fatores que influenciam
a rapidez das transformações químicas relacionadas
aos exemplos 1,2 e 3, respectivamente?
Considere a combustão completa do butan-2-ol. Sabendo-se
que, em uma hora de reação, foram produzidos 63.36 kg
de gás carbônico, a velocidade da reação do álcool, em mols
consumidos por minuto, é de:
A hematita (α-Fe2O3), além de ser utilizada para
obtenção do aço, também é utilizada como um catalisador
de processos químicos, como na síntese da amônia,
importante matéria-prima da indústria agroquímica.
MEDEIROS, M. A. F Química Nova na Escola, São Paulo, v. 32, n. 3, ago. 2010 (adaptado).
O uso da hematita viabiliza economicamente a produção
da amônia, porque
A hematita (α-Fe2O3), além de ser utilizada para obtenção do aço, também é utilizada como um catalisador de processos químicos, como na síntese da amônia, importante matéria-prima da indústria agroquímica.
MEDEIROS, M. A. F Química Nova na Escola, São Paulo, v. 32, n. 3, ago. 2010 (adaptado).
O uso da hematita viabiliza economicamente a produção da amônia, porque
Há processos industriais que envolvem reações
químicas na obtenção de diversos produtos ou bens
consumidos pelo homem. Determinadas etapas de
obtenção desses produtos empregam catalisadores
químicos tradicionais, que têm sido, na medida do
possível, substituídos por enzimas.
Em processos industriais, uma das vantagens de se
substituírem os catalisadores químicos tradicionais por
enzimas decorre do fato de estas serem
Há processos industriais que envolvem reações químicas na obtenção de diversos produtos ou bens consumidos pelo homem. Determinadas etapas de obtenção desses produtos empregam catalisadores químicos tradicionais, que têm sido, na medida do possível, substituídos por enzimas.
Em processos industriais, uma das vantagens de se substituírem os catalisadores químicos tradicionais por enzimas decorre do fato de estas serem
Acerca de reações químicas, assinale a opção correta.


A partir dessas informações, julgue o item e assinale a opção correta
O valor da constante de velocidade k para a reação cujos dados estão representados na tabela do texto é maior que 1 s -1 .


A partir dessas informações, julgue o item e assinale a opção correta
A concentração dos reagentes e a temperatura são fatores que afetam a velocidade de uma reação química, uma vez que, para ocorrer uma reação, é necessário que as moléculas dos reagentes se aproximem de modo que seus átomos possam ser trocados ou rearranjados na estrutura molecular.


A partir dessas informações, julgue o item e assinale a opção correta
A reação cujos dados estão representados na tabela do texto corresponde a uma reação de segunda ordem.


A partir dessas informações, julgue o item e assinale a opção correta
O efeito, mencionado no texto, que é observado em uma célula nervosa pós-sináptica após cerca de 1 ms da ligação de um neurotransmissor ao seu receptor decorre de mudança na distribuição de cargas elétricas nas duas faces da membrana.


A partir dessas informações, julgue o item e assinale a opção correta
A barreira de energia que deve ser superada pelos reagentes para formar os produtos denomina-se barreira catalítica.


A partir dessas informações, julgue o item e assinale a opção correta