Questão fcc5f3de-d9
Prova:UEA 2019
Disciplina:Química
Assunto:Cinética Química, Velocidade de Reação, Energia de Ativação, Concentração, Pressão, Temperatura e Catalisador
Analise o esquema.

Admita que a reação ocorrida seja instantânea.
Se a velocidade de consumo do bicarbonato de sódio foi
2,5 × 10–3
mol/L × s, a velocidade de formação do gás carbônico foi de
Analise o esquema.

Admita que a reação ocorrida seja instantânea.
Se a velocidade de consumo do bicarbonato de sódio foi
2,5 × 10–3
mol/L × s, a velocidade de formação do gás carbônico foi de
A
1,76 × 10–5
g/L × s
B
2,20 × 10–5
g/L × s.
C
1,10 × 10–1
g/L × s.
D
5,50 × 10–1
g/L × s.
E
1,40 × 10–3
g/L × s.
Gabarito comentado
Talita Goulart Graduação e Mestrado em Engenharia Química pela UFRRJ, Doutoranda em Engenharia Química pela COPPE/UFRJ, Professora de Química.
Para a resolução desta questão de cinética química é importante saber a relação entre a velocidade de consumo do reagente e a velocidade de formação do produto.
Para uma reação genérica:
Para uma reação genérica:
aA + bB → cC + dD
A velocidade média da reação (vm) é definida como:
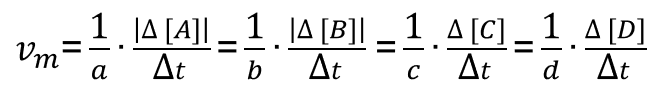
Sendo assim, observemos os dados e a resolução da questão:
Dados:
velocidade de formação do CO2 = 2,5
mol/L × s;
Massas molares (fornecidas na tabela, g/mol): C = 12; O = 16.
Resolução:
De acordo com o enunciado, a reação ocorrida é a seguinte:
NaHCO3 + HCl → CO2 + H2O + NaCl
Como a relação de número de mols é a mesma entre o NaHCO3 e o CO2, temos a seguinte relação entre suas velocidades:
|velocidade de consumo do NaHCO3| = velocidade de formação do CO2 = 2,5 mol/L × s
A velocidade da resposta está em g/L, portanto, é preciso passar de mol/L a g/L, utilizando a massa molar (MM) do CO2:
De acordo com o enunciado, a reação ocorrida é a seguinte:
NaHCO3 + HCl → CO2 + H2O + NaCl
Como a relação de número de mols é a mesma entre o NaHCO3 e o CO2, temos a seguinte relação entre suas velocidades:
|velocidade de consumo do NaHCO3| = velocidade de formação do CO2 = 2,5 mol/L × s
A velocidade da resposta está em g/L, portanto, é preciso passar de mol/L a g/L, utilizando a massa molar (MM) do CO2:
MM (CO2) = 12 + 2 × 16 g = 44 g
1 mol de CO2 possui 44 g
2,5 × 10–3 ------------ X
X = 2,5 × 10–3 × 44 = 110 × 10–3 = 1,10 × 10–1 g
Dessa forma, tem-se que velocidade de formação do CO2 é igual a 1,10 × 10–1 g/L × s.
Gabarito do Professor: Letra C.
Gabarito do Professor: Letra C.






