Um experimento relativamente simples que pode ser utilizado para ilustrar o funcionamento de uma pilha consiste em espetar placas (também podem ser usados bastões) de cobre e zinco num limão adequadamente amassado e cortado. Um sistema como esse pode fazer funcionar pequenos dispositivos eletrônicos como alguns relógios digitais. A seguir são dados os potenciais padrão de redução das espécies presentes:
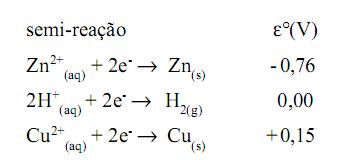
Julgue as afirmações a seguir usando (C) para certo e (E) para errado com base nas informações fornecidas:
( ) O suco do limão fará o papel de uma solução eletrolítica, que geralmente é alguma solução iônica. O caráter iônico possibilita que íons livres se movimentem no interior da mistura.
( ) O suco do limão é um meio básico, devido à grande concentração de ácido cítrico do limão, ácido fraco, pois o ânion produzido da dissociação do ácido reage com a água produzindo íons OH- , responsável pela basicidade do meio.
( ) Quando se insere o eletrodo de cobre no limão ocorre reação química entre a placa de cobre e os íons H+, produzindo íons Cu2+ e gás hidrogênio.
( ) Quando se insere o eletrodo de zinco no limão ocorre reação química entre os átomos de zinco e os íons H+, produzindo íons Zn2+ e o H2(g) .
( ) Os elétrons migram da placa de cobre para a placa de zinco a fim de reduzir os íons H+. A redução de dois íons H+ dá origem a uma molécula de H2 (gás hidrogênio).
( ) Ao fechar o circuito elétrico, os elétrons livres na placa de zinco, pólo negativo, se dirigem pelo fio até a placa de cobre, pólo positivo. Então, os átomos de zinco migram da placa para o suco do limão, perdendo dois elétrons cada um, que irão fazer parte da corrente elétrica.
( ) Nenhuma reação química é responsável pela produção da corrente elétrica que faz o relógio funcionar. Afinal, as substâncias são apenas matéria e não energia.
Assinale a alternativa que representa a seqüência correta.
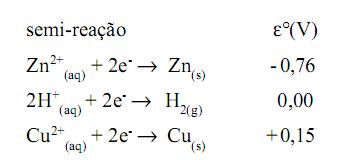
Julgue as afirmações a seguir usando (C) para certo e (E) para errado com base nas informações fornecidas:
( ) O suco do limão fará o papel de uma solução eletrolítica, que geralmente é alguma solução iônica. O caráter iônico possibilita que íons livres se movimentem no interior da mistura.
( ) O suco do limão é um meio básico, devido à grande concentração de ácido cítrico do limão, ácido fraco, pois o ânion produzido da dissociação do ácido reage com a água produzindo íons OH- , responsável pela basicidade do meio.
( ) Quando se insere o eletrodo de cobre no limão ocorre reação química entre a placa de cobre e os íons H+, produzindo íons Cu2+ e gás hidrogênio.
( ) Quando se insere o eletrodo de zinco no limão ocorre reação química entre os átomos de zinco e os íons H+, produzindo íons Zn2+ e o H2(g) .
( ) Os elétrons migram da placa de cobre para a placa de zinco a fim de reduzir os íons H+. A redução de dois íons H+ dá origem a uma molécula de H2 (gás hidrogênio).
( ) Ao fechar o circuito elétrico, os elétrons livres na placa de zinco, pólo negativo, se dirigem pelo fio até a placa de cobre, pólo positivo. Então, os átomos de zinco migram da placa para o suco do limão, perdendo dois elétrons cada um, que irão fazer parte da corrente elétrica.
( ) Nenhuma reação química é responsável pela produção da corrente elétrica que faz o relógio funcionar. Afinal, as substâncias são apenas matéria e não energia.
Assinale a alternativa que representa a seqüência correta.
Gabarito comentado
(C)
O suco do limão fará o papel de uma solução eletrolítica, que geralmente é
alguma solução iônica. O caráter iônico possibilita que íons livres se
movimentem no interior da mistura.
(E)
O suco do limão é um meio básico, devido à grande concentração de ácido cítrico
do limão, ácido fraco, pois o ânion produzido da dissociação do ácido reage com
a água produzindo íons OH- , responsável pela basicidade do meio.
(E)
Quando se insere o eletrodo de cobre no limão ocorre reação química entre a
placa de cobre e os íons H+, produzindo íons Cu2+ e gás hidrogênio.
(C)
Quando se insere o eletrodo de zinco no limão ocorre reação química entre os
átomos de zinco e os íons H+, produzindo íons Zn2+ e o H2(g) .
(E)
Os elétrons migram da placa de cobre para a placa de zinco a fim de reduzir os
íons H+. A redução de dois íons H+ dá origem a uma molécula de H2 (gás
hidrogênio).
(C)
Ao fechar o circuito elétrico, os elétrons livres na placa de zinco, pólo
negativo, se dirigem pelo fio até a placa de cobre, pólo positivo. Então, os
átomos de zinco migram da placa para o suco do limão, perdendo dois elétrons
cada um, que irão fazer parte da corrente elétrica.
(E)
Nenhuma reação química é responsável pela produção da corrente elétrica que faz
o relógio funcionar. Afinal, as substâncias são apenas matéria e não energia.
Opção correta C.






