A reação de redução do cobre ocorre na etapa









DADOS QUE PODEM SER USADOS NESTA PROVA

As baterias recarregáveis possuem a característica de prolongar muito sua vida útil, o que aumenta a relação custo-benefício. A bateria recarregável mais conhecida é a bateria de chumbo usada nos carros, que, por armazenar energia elétrica, é definida como bateria de armazenamento. Esse tipo de bateria consiste em seis células, cada uma gerando 2,0 V para um total de 12,0 V. A reação celular geral é dada pela seguinte equação química:
Pb(s) + PbO2(s) + 2H2SO4(aq) → 2PbSO4(s) + 2H2O(l)
Sobre essa reação, é correto afirmar que
DADOS QUE PODEM SER USADOS NESTA PROVA

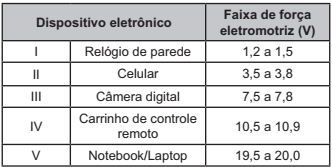






DADOS QUE PODEM SER USADOS NESTA PROVA





Reação E°red
piruvato + 2H+ + 2e- → lactato -0,185 V
NAD+ + H+ + 2e- → NADH -0,315 V
 da reação de oxirredução que promove a
formação do lactato?
da reação de oxirredução que promove a
formação do lactato?