Questão 544f4310-b8
Prova:UNB 2024
Disciplina:Química
Assunto:Interações Atômicas: Ligações Iônicas, Ligações Covalentes e Ligações Metálicas. Ligas Metálicas., Substâncias e suas propriedades
A partir das informações precedentes, julgue o item que se
segue.
Para a ligação C−C esticada 0,2 Å além de sua respectiva
distâncias de equilíbrio, a força de interação na ligação do
eteno é duas vezes mais intensa que na ligação do etano.
A partir das informações precedentes, julgue o item que se segue.
Para a ligação C−C esticada 0,2 Å além de sua respectiva distâncias de equilíbrio, a força de interação na ligação do eteno é duas vezes mais intensa que na ligação do etano.
Uma IA foi treinada para modelar sistemas moleculares
com base na lei Hooke, ou seja, para representar as ligações
químicas covalentes entre os átomos por molas, cujas constantes
elásticas dependem do tipo de ligação química (simples, duplas
ou triplas). A energia potencial da mola é dada pela relação V = 1/2 k (r - re)2, em que re é a distância de equilíbrio em uma
dada ligação covalente e k é a constante elástica da mola que
simula a intensidade da ligação química. Na tabela a seguir, são
apresentados dados para as ligações covalentes C - H e C - C.
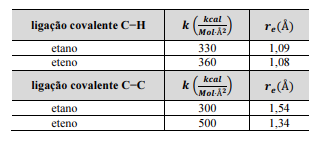
Uma IA foi treinada para modelar sistemas moleculares
com base na lei Hooke, ou seja, para representar as ligações
químicas covalentes entre os átomos por molas, cujas constantes
elásticas dependem do tipo de ligação química (simples, duplas
ou triplas). A energia potencial da mola é dada pela relação V = 1/2 k (r - re)2, em que re é a distância de equilíbrio em uma
dada ligação covalente e k é a constante elástica da mola que
simula a intensidade da ligação química. Na tabela a seguir, são
apresentados dados para as ligações covalentes C - H e C - C.

C
Certo
E
Errado
Estatísticas
Aulas sobre o assunto
- •
Interações Atômicas: Ligações Iônicas, Ligações Covalentes e Ligações Metálicas. Ligas Metálicas.
Substâncias e suas propriedades
6 aulas
Interações Atômicas: Geometria Molecular, Polaridade da ligação e da Molécula, Forças Intermoleculares e Número de Oxidação.
Substâncias e suas propriedades
2 aulas
Número da Oxidação
Substâncias e suas propriedades
1 aulas
Estudo da matéria: substâncias, misturas, processos de separação.
Substâncias e suas propriedades
2 aulas
Forças Intermoleculares
Substâncias e suas propriedades
1 aulas
Transformações: Estados Físicos e Fenômenos
Substâncias e suas propriedades
1 aulas
Estrutura Atômica: números de massa, átomo neutro e íon, elemento químico e semelhanças atômicas
Transformações Químicas
2 aulas
Tabela Periódica: elementos químicos, propriedades periódicas e reações químicas
Transformações Químicas
5 aulas
Estudo dos Gases - Lei, Teoria Cinética, Equação e Mistura dos Gases. Princípio de Avogadro.
Transformações Químicas
4 aulas
Teoria Atômica: Modelo atômico de Dalton, Thomson, Rutherford, Rutherford-Bohr
Transformações Químicas
4 aulas
Substâncias Inorgânicas: dissociação iônica e ionização, conceitos de ácido-base.
Soluções e Substâncias Inorgânicas
3 aulas
Substâncias Inorgânicas e suas características: Ácidos, Bases, Sais e Óxidos. Reações de Neutralização.
Soluções e Substâncias Inorgânicas
1 aulas
Transformações Químicas
15 aulas
Substâncias e suas propriedades
13 aulas
Soluções e Substâncias Inorgânicas
4 aulas






