Questão 1369413d-b0
Prova:UFT 2013
Disciplina:Química
Assunto:Transformações Químicas e Energia, Eletroquímica: Oxirredução, Potenciais Padrão de Redução, Pilha, Eletrólise e Leis de Faraday.
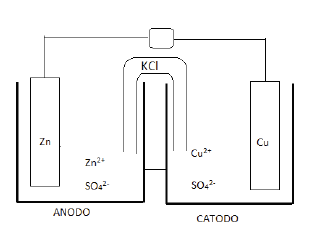
A figura a seguir representa uma célula galvânica conhecida
como a pilha de Daniell. No compartimento da esquerda, tem
uma placa de zinco mergulhada em solução de sulfato de zinco
a 1,00 mol/L e, no compartimento da direita, tem uma placa de
cobre mergulhada em uma solução de sulfato de cobre 1,00
mol/L. As placas estão interligadas por um fio condutor (circuito
externo) e as soluções estão unidas por uma ponte salina que
é uma solução saturada de cloreto de potássio. O potencial
padrão de redução do Zn2+ é -0,76V e do Cu2+ é +0,34V.
Analise as afirmações a seguir em relação ao funcionamento
dessa pilha:
I. No anodo ocorre a oxidação do zinco e no catodo a redução
do cobre.
II. A carga do anodo é positiva e a do catodo negativa.
III. O fluxo de elétrons ocorre do anodo para o catodo através
do circuito externo.
IV. Na placa de zinco, ocorre corrosão, liberando íons Zn2+ para
a solução, enquanto que, na placa de cobre, ocorre
deposição de Cu metálico.
V. A função da ponte salina é balancear as cargas, sendo que
os cátions K+
migram para a solução de sulfato de zinco e
os ânions Cl-
migram para a solução de sulfato de cobre.
VI. O potencial padrão dessa pilha é 1,10 volts.
VII. O Zn2+ é o agente oxidante e o Cu2+ é o agente redutor.
A alternativa que indica todas as afirmações CORRETAS é:
A figura a seguir representa uma célula galvânica conhecida
como a pilha de Daniell. No compartimento da esquerda, tem
uma placa de zinco mergulhada em solução de sulfato de zinco
a 1,00 mol/L e, no compartimento da direita, tem uma placa de
cobre mergulhada em uma solução de sulfato de cobre 1,00
mol/L. As placas estão interligadas por um fio condutor (circuito
externo) e as soluções estão unidas por uma ponte salina que
é uma solução saturada de cloreto de potássio. O potencial
padrão de redução do Zn2+ é -0,76V e do Cu2+ é +0,34V.

Analise as afirmações a seguir em relação ao funcionamento
dessa pilha:
I. No anodo ocorre a oxidação do zinco e no catodo a redução
do cobre.
II. A carga do anodo é positiva e a do catodo negativa.
III. O fluxo de elétrons ocorre do anodo para o catodo através
do circuito externo.
IV. Na placa de zinco, ocorre corrosão, liberando íons Zn2+ para
a solução, enquanto que, na placa de cobre, ocorre
deposição de Cu metálico.
V. A função da ponte salina é balancear as cargas, sendo que
os cátions K+
migram para a solução de sulfato de zinco e
os ânions Cl-
migram para a solução de sulfato de cobre.
VI. O potencial padrão dessa pilha é 1,10 volts.
VII. O Zn2+ é o agente oxidante e o Cu2+ é o agente redutor.
A alternativa que indica todas as afirmações CORRETAS é:
A
II, III e IV apenas.
B
I, III, IV e VI apenas.
C
I, II, III, V e VI apenas.
D
II, III, IV, V, IV e VII apenas.
E
I, II, III, IV, V, VI e VII.






