4468b587-59
UFRN 2012 - Biologia - Introdução aos estudos das Plantas, Identidade dos seres vivos
Em um experimento, um tipo de planta que se reproduz tanto de forma sexuada como assexuada é cultivada em dois ambientes artificiais distintos (I e II). No ambiente I , as condições de temperatura e umidade são constantes e não há presença de insetos. No ambiente II, há presença de insetos e a temperatura e a umidade são instáveis .
Considerando os dois ambientes, a reprodução que teria melhor resultado na produção vegetal é:
Em um experimento, um tipo de planta que se reproduz tanto de forma sexuada como assexuada é cultivada em dois ambientes artificiais distintos (I e II). No ambiente I , as condições de temperatura e umidade são constantes e não há presença de insetos. No ambiente II, há presença de insetos e a temperatura e a umidade são instáveis .
Considerando os dois ambientes, a reprodução que teria melhor resultado na produção vegetal é:
Considerando os dois ambientes, a reprodução que teria melhor resultado na produção vegetal é:
A
Nos dois ambientes, reprodução sexuada, pois esta gera indivíduos idênticos que produzem um maior número de plantas.
B
No ambiente II , reprodução assexuada, pois uma planta bem adaptada irá gerar um descendente também bem adaptado.
C
os dois ambientes, reprodução assexuada, pois esta gera plantas já maduras e adaptadas, não apresentando fragilidades em presença de pragas.
D
No ambiente II, reprodução sexuada, pois esta gera sempre uma variedade de indivíduos que irão se adaptar a qualquer ambiente.






 , é um fármaco com ação estimulante sobre o sistema nervoso central. Esse fármaco pode ser representado por dois compostos que apresentam a mesma fórmula estrutural, mas só um deles tem efeito fisiológico. A obtenção de medicamentos que tenham esse comportamento constitui um desafio para os químicos. O Prêmio Nobel de Química, em 2001, foi outorgado aos químicos William S. Knowles (EUA), K. Barry Sharpless (EUA) e Ryoj i Noyori (Japão) por desenvolverem métodos de sínteses com catalisadores assimétricos que permitem obter o enantiômero que interessa. O comportamento da anfetamina e os trabalhos dos químicos laureados com o Nobel dizem respeito
, é um fármaco com ação estimulante sobre o sistema nervoso central. Esse fármaco pode ser representado por dois compostos que apresentam a mesma fórmula estrutural, mas só um deles tem efeito fisiológico. A obtenção de medicamentos que tenham esse comportamento constitui um desafio para os químicos. O Prêmio Nobel de Química, em 2001, foi outorgado aos químicos William S. Knowles (EUA), K. Barry Sharpless (EUA) e Ryoj i Noyori (Japão) por desenvolverem métodos de sínteses com catalisadores assimétricos que permitem obter o enantiômero que interessa. O comportamento da anfetamina e os trabalhos dos químicos laureados com o Nobel dizem respeito 
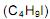 com a água a 25 o C pode ser estudada do ponto de vista da cinética química. A equação da reação é mostrada a seguir:
com a água a 25 o C pode ser estudada do ponto de vista da cinética química. A equação da reação é mostrada a seguir: 



 , medida em metros, isto é,
, medida em metros, isto é, 
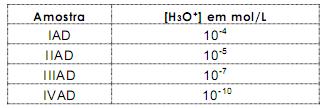
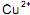 da solução aquosa.
da solução aquosa.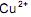 da solução aquosa.
da solução aquosa.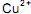 da solução aquosa.
da solução aquosa.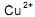 da solução aquosa.
da solução aquosa.