
Disponível em:<https://rachacuca.com.br/educacao/vestibular/tags/biologia>.Acesso em: 8 ago. 2018.
A seta indica, na ilustração, um tipo de ligação química
que, se estiver entre uma citosina e uma guanina,
corresponde a







A imagem a seguir é de uma típica estação de tratamento de água.

Em uma estação como essa, o objetivo é obter água
O gráfico a seguir mostra a relação entre o número de átomos de carbono e a solubilidade em água de uma série de ácidos dicarboxílicos.

Disponível em:
<http://www.profpc.com.br/Qu%C3%ADmica%20na%20Cozinha/
Qu%C3%ADmica%20dos%20Sentidos/Qu%C3%ADmica_sentidos.htm#PO
NTO_DE_FUS%C3%83O_E_PONTO_DE_EBULI%C3%87% C3%83º>.
Acesso em: 9 ago. 2018.
De acordo com esse gráfico, a solubilidade em água do
ácido succínico é aproximadamente 6,8 g/mL. A fórmula
química desse ácido é
COMO FUNCIONAM OS DETERGENTES
Os detergentes são substâncias tensoativas, isto é, diminuem a tensão superficial – a capacidade que as moléculas de água têm de se manter unidas fortemente. Com as ligações, entre suas moléculas, enfraquecidas, a água umedece mais facilmente o objeto a ser lavado. Isso acontece porque as longas moléculas do detergente contêm dois grupos de átomos: uns que se dissolvem facilmente em gordura e outros que se dissolvem em água. Por isso, a solução água detergente consegue emulsionar a gordura, ou seja, “quebra” as películas de gordura em uma infinidade de gotículas microscópicas, que ficam dispersas na solução. A espuma tem um efeito mecânico na limpeza, porque mantém as partículas de sujeira sólida em suspensão, impedindo-as de se depositarem na superfície lavada.
Disponível em: http://super.abril.com.br/ciencia/detergentes. Acesso em: 15 de setembro de 2015.
Os detergentes podem ser fabricados a partir do benzeno pela sequência reacional apresentada abaixo:

Analisando a sequência reacional de obtenção do
detergente, depreende-se que as reações de obtenção de
A, B e C se classificam em
ENGENHEIRAS DO CHILE CRIAM TECNOLOGIA QUE
RECARREGA BATERIAS COM PLANTAS
Uma tecnologia vinda do Chile pode ser uma alternativa curiosa para a recarga de dispositivos eletrônicos: com ela, em vez de ir atrás de uma tomada, você precisa procurar uma planta.
Trata-se do projeto E-Kaia, que começou como um trabalho universitário de três amigas e se transformou em uma startup que já acumula prêmios mesmo sem o produto no mercado. O E-Kaia captura energia de plantas utilizando uma “placa de biocircuitos” e só precisa ser “enterrado” em um local de cultivo de uma planta bem cuidada. Aparentemente, o sistema recupera energia restante da fotossíntese e é capaz de fornecer 5 volts a 0,5 ampere.
O grupo afirma que a planta também não apresentou problemas de crescimento ou atraiu fungos e pragas. Gadgets e LEDs de baixo consumo podem receber a energia, embora a velocidade de recarga não tenha sido divulgada.
Disponível em: http://www.tecmundo.com.br/bateria/85844-engenheiraschile-criam-tecnologia-recarrega-baterias-plantas.htm. Acesso em: 13 de setembro de 2015. Adaptado.
[Dados: M(Cu) = 63,5 g/mol; 1F = 96500 C/mol de elétrons.]
De acordo com o texto, qual a massa máxima de cobre que pode ser depositada após 38600 s de processo eletrolítico?
DESMINERALIZAÇÃO E MINERALIZAÇÃO
Os dentes sofrem contínuos processos de desmineralização seguida por remineralização e restabelecimento da integridade do esmalte dentário devido ao controle do biofilme dentário (placa bacteriana), à presença de saliva, entre outros fatores. Quando a hidroxiapatita se dissolve, em um processo chamado desmineralização, os íons dispersam-se na saliva:
Ca5(PO4)3OH(s) ⇄ 5Ca2+(aq) + 3PO3-4(aq) + OH-(aq)
Sendo os fosfatos de metais alcalino-terrosos pouco solúveis, essa reação não se dá com grande extensão no sentido direto. A reação inversa, chamada mineralização, é a defesa natural do organismo contra a cárie:
5Ca2+(aq) + 3PO3-4(aq) + OH-(aq) ⇄ Ca5(PO4)3OH(s)
Nos adultos, esses dois processos se dão, aproximadamente, à mesma velocidade
Disponível em: https://desmineralizacaod.wordpress.com/2011/06/09/des mineralizacao-e-mineralizacao-2/. Acesso em: 16 de agosto de 2015.
Após uma refeição, as bactérias presentes na boca
decompõem parte dos alimentos, produzindo ácidos
orgânicos como o ácido acético e o ácido lático. Portanto,
é pertinente inferir que
BICARBONATO DE SÓDIO PARA
COMBATER RESFRIADOS E GRIPES
Pode ajudar a manter um correto equilíbrio no pH do sangue, o que ajuda a combater e evitar as gripes e resfriados. Em 1924, o Dr. Volney S. Cheney, um médico que trabalhou para o serviço de saúde pública nos Estados Unidos, publicou o artigo “Arm & Hammer Baking Soda Medical Use” no qual relatou os resultados de alguns testes usando o bicarbonato de sódio, e o resultado foi que quem fez o tratamento com esse mágico mineral não contraiu nenhum resfriado ou gripe. O tratamento para resfriados, usando bicarbonato de sódio, é muito fácil de fazer, junte 1/2 colher de chá (0,03 mol) de bicarbonato de sódio em um copo de água fria (100 mL) e beba em seguida. Deve-se beber um copo de manhã e outro à noite até os sintomas do resfriado desaparecerem por completo.
Disponível em: http://www.remedios-caseiros.com/remedios/bicarbonatode-sodio.html. Adaptada. Acesso em: 11 de agosto de 2015.
[Dados: Kw = 1 · 10–14; Ka(H2CO3) = 4,3 · 10–7; √69 ≅ 8,3; 3/4,3 ≅ 0,69; log 8,3 ≅ 0,92]
De acordo com o texto, é pertinente inferir que o pH da solução de bicarbonato de sódio é, aproximadamente,
A Cáritas Diocesana de Sobral do Ceará lançou, nesta semana, o livro “No Ceará – A peleja da vida contra o urânio”, que denuncia a exploração de urânio e fosfato da Mina de Itataia, em Santa Quitéria, Sertão Central cearense.
[...] A publicação esclarece que o urânio será destinado à produção de energia, demandada principalmente pelo setor industrial, e o fosfato terá como fim a produção de adubos químicos e ração animal para o agronegócio. De acordo com o Governo do Estado do Ceará, a previsão é de que sejam produzidas 240 mil toneladas de fosfato por ano e 1.600 toneladas anuais de urânio; ainda segundo o Governo do Estado, o urânio será utilizado pela usina nuclear Angra III, no Rio de Janeiro.
Disponível em: http://www.a12.com/noticias/detalhes/livro-denuncia-riscos-da-exploracao-do-uranio-da-mina-de-itataia-no-ceara. Acesso em: 15 de setembro de 2015.
[Dados: t(1/2) (U – 235) = 7 milhões de anos.]
Considerando que o isótopo de urânio 235 (urânio físsil) corresponde a 0,7% da mistura isotópica, é pertinente inferir que o número de meias-vidas necessário para que o urânio físsil produzido anualmente no Ceará tenha sua massa reduzida a 87,5 kg é
OS RISCOS DA FEBRE ALTA
Nós, como todos os mamíferos, somos animais homeotérmicos, isto é, nossa temperatura se mantém constante independentemente da temperatura do local onde nos encontramos. Todas as reações do complexo bioquímico representado por nosso organismo, como as envolvidas na digestão, ocorrem nessa temperatura. Quando temos febre, todas essas reações passam a ter sua velocidade aumentada. Uma elevação em 1 °C ou 2 °C na temperatura faz que elas se acelerem substancialmente. Como a temperatura corporal aumenta, o metabolismo se acelera, produzindo mais calor. Nesse processo, nosso ritmo respiratório aumenta porque a demanda de oxigênio passa a ser maior. Com isso, perdemos mais água, comprometendo o sistema circulatório, o que torna mais difícil a eliminação de calor pela pele. Acima de 41,5 °C, as funções celulares ficam muito prejudicadas, e o indivíduo perde a consciência, por isso febres altas podem ser fatais.
Disponível em: Química: ações e aplicações: 2ª série/Vera Lúcia Duarte de
Novais – 1ª ed. – São Paulo: FTD, 2013. Adaptado.
A análise do texto permite inferir que o risco de morte
CAFÉ SOLÚVEL
Simplificadamente, podemos dizer que o processo se baseia em um conjunto de dois procedimentos que retiram água do sistema: resfriamento e sublimação. Como ele é feito? O café é dissolvido em água em ebulição e, assim que essa solução é obtida, passa por um processo de resfriamento até solidificar. Em seguida, a solução congelada é colocada em um recipiente fechado onde será submetida à significativa redução de pressão. [...] A queda de pressão permite que a água congelada passe diretamente do estado sólido ao gasoso (sublimação), restando o pó do café, em condições de ser embalado.
Disponível em: Química: ações e aplicações: 2ª série/ Vera Lúcia Duarte de
Novais – 1ª ed. – São Paulo: FTD, 2013.
O método de obtenção do café solúvel denomina-se
Uma substância muito usada na produção de compressas frias (BOLSAS DE FRIO INSTANTÂNEO) é o nitrato de amônio sólido. Ao ser dissolvido em água, há uma queda brusca na temperatura do sistema, chegando a uma temperatura de – 5,6 °C, aproximadamente, sem que haja solidificação do líquido.
A equação química representativa do processo é:

Disponível em: Química: ações e aplicações: 2ª série/Vera Lúcia Duarte de
Novais – 1ª ed. –
São Paulo: FTD, 2013. Adaptado.
De acordo com a termodinâmica, é pertinente inferir que
Também conhecido como gás natural ou gás dos pântanos, o metano é um gás representado pela fórmula química CH4, incolor, de odor fraco a levemente adocicado, altamente inflamável, estável, praticamente insolúvel em água e solúvel em solventes orgânicos (álcoois, benzenos, ésteres e gasolina). Trata-se do composto mais simples e abundante do grupo dos hidrocarbonetos. O metano se forma a partir da fermentação de resíduos orgânicos pela ação de bactérias, como a decomposição do lixo orgânico nos aterros sanitários, a emissão de vulcões de lama, a digestão de herbívoros, a extração de combustível mineral, o metabolismo de certas espécies bacterianas, o apodrecimento de vegetais nos pântanos (sendo, por isso, chamado de gás dos pântanos), entre outros processos. Por esse motivo, nos aterros sanitários, são colocadas muitas “chaminés”, que atravessam as várias camadas de material, pelos quais escoam os gases formados pela fermentação do lixo.
Disponível em: http://www.infoescola.com/compostosquimicos/metano/.
Acesso em: 16 de agosto de 2015.
Dados:
C(graf.) + O2(g) → CO2(g) ∆H = – 393,5 kJ/mol
H2(g) + 1/2 O2(g) → H2O(ℓ) ∆H = – 285,8 kJ/mol
CH4(g) + 2O2(g) → CO2(g) + 2H2O(ℓ) ∆H = – 889,5 kJ/mol
A análise dos dados apresentados permite inferir que o
calor de formação do metano é
A imagem a seguir é a fotografia de uma impressão digital coletada na superfície de um pedaço de madeira. Para obtê-la, foi utilizada uma técnica baseada na reação entre o sal do suor NaCℓ, presente na impressão digital, com solução aquosa diluída de um reagente específico. Depois de secar em uma câmara escura, a madeira é exposta à luz solar.

Disponível em: guiadoestudante.abril.com.br. Acesso em: 15 de agosto 2015.
Sobre o processo químico descrito, é pertinente inferir
que a solução usada foi de
PESQUISA GERA CACHAÇA “TIPO EXPORTAÇÃO”
Método ajuda a diminuir teor de cobre na bebida, vencendo regras do mercado internacional para consumo de destilados. Brasil permite até 5 mg/L do metal na aguardente, mas a Europa exige um máximo de 2 mg/L; a técnica não muda o sabor ou o aroma do produto.
[...] Para retirar o metal da bebida, os pesquisadores [...] misturaram à cachaça recém-destilada mármore ou calcário em pó, ambos formados basicamente por carbonato de cálcio. [...] é como se o carbonato “largasse” o cálcio e agarrasse o cobre, formando um precipitado - uma espécie de pó, que é facilmente retirado por uma filtragem. “Conseguimos fazer que uma bebida que tinha 20 mg/L de cobre chegue a 2 mg/L”, diz Oliveira.
Disponível em: http://www.ufcg.edu.br/prt_ufcg/assessoria_impre nsa/mostra_noticia.php?codigo=2905. Acesso em: 16 de agosto de 2015.
[Dados: M(Ca) = 40 g/mol; M(Cu) = 63,5 g/mol.]
A análise dos dados permite inferir que
Observe a curva de titulação de uma solução aquosa de ácido acético 1 mol/L com solução aquosa de hidróxido de sódio 1 mol/L.
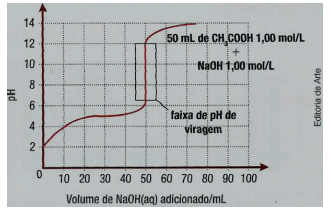
MASTERTON, W. L.; SLOWINSKI, E. J. Química geral superior.
4 ed. Rio de Janeiro: Interamericana, 1978, p. 392.
De acordo com os dados apresentados, é pertinente inferir
que
CARGUEIRO COM 2400 TONELADAS DE ÁCIDO
SULFÚRICO VIROU NO RIO RENO
Um cargueiro com 2400 toneladas de ácido sulfúrico virou-se [...] no rio Reno, ao passar pela Alemanha. Dois membros da tripulação estão dados como desaparecidos. [...]
Disponível em: http://www.publico.pt/ciencia/noticia/cargueiro-com-2400-- toneladas-de-acido-sulfurico-virouse-no-rio-reno-1475034. Acesso em: 15 de agosto de 2015.
[Dados: M(H2SO4) = 98 g/mol; M[Ca(OH)2] = 74 g/mol; N.A. = 6,0 ˑ 1023]
Supondo que toda a massa fornecida seja só de ácido sulfúrico, pode-se inferir que