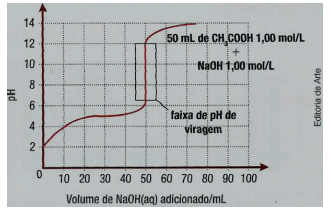
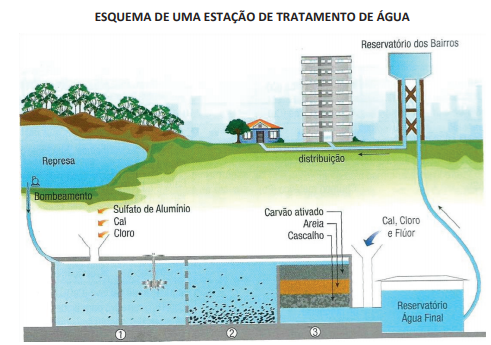
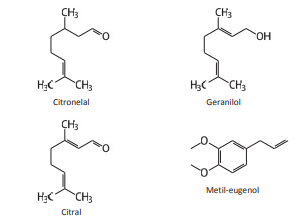
COMO FUNCIONAM OS DETERGENTES
Os detergentes são substâncias tensoativas,
isto é, diminuem a tensão superficial – a capacidade que
as moléculas de água têm de se manter unidas
fortemente. Com as ligações, entre suas moléculas,
enfraquecidas, a água umedece mais facilmente o objeto a
ser lavado. Isso acontece porque as longas moléculas do
detergente contêm dois grupos de átomos: uns que se
dissolvem facilmente em gordura e outros que se
dissolvem em água. Por isso, a solução água detergente
consegue emulsionar a gordura, ou seja, “quebra” as
películas de gordura em uma infinidade de gotículas
microscópicas, que ficam dispersas na solução. A espuma
tem um efeito mecânico na limpeza, porque mantém as
partículas de sujeira sólida em suspensão, impedindo-as
de se depositarem na superfície lavada.
Disponível em:
http://super.abril.com.br/ciencia/detergentes.
Acesso em: 15 de setembro de 2015.
Os detergentes podem ser fabricados a partir do benzeno
pela sequência reacional apresentada abaixo:

Analisando a sequência reacional de obtenção do
detergente, depreende-se que as reações de obtenção de
A, B e C se classificam em
COMO FUNCIONAM OS DETERGENTES
Os detergentes são substâncias tensoativas, isto é, diminuem a tensão superficial – a capacidade que as moléculas de água têm de se manter unidas fortemente. Com as ligações, entre suas moléculas, enfraquecidas, a água umedece mais facilmente o objeto a ser lavado. Isso acontece porque as longas moléculas do detergente contêm dois grupos de átomos: uns que se dissolvem facilmente em gordura e outros que se dissolvem em água. Por isso, a solução água detergente consegue emulsionar a gordura, ou seja, “quebra” as películas de gordura em uma infinidade de gotículas microscópicas, que ficam dispersas na solução. A espuma tem um efeito mecânico na limpeza, porque mantém as partículas de sujeira sólida em suspensão, impedindo-as de se depositarem na superfície lavada.
Disponível em: http://super.abril.com.br/ciencia/detergentes. Acesso em: 15 de setembro de 2015.
Os detergentes podem ser fabricados a partir do benzeno pela sequência reacional apresentada abaixo:

Analisando a sequência reacional de obtenção do
detergente, depreende-se que as reações de obtenção de
A, B e C se classificam em