796b3aef-fc
UFT 2019 - Química - Eletroquímica: Oxirredução, Potenciais Padrão de Redução, Pilha, Eletrólise e Leis de Faraday.
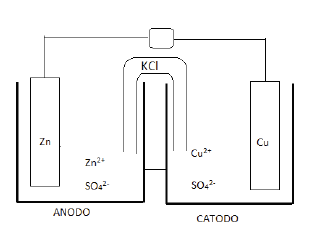
Sobre a eletrólise de uma solução aquosa de cloreto de sódio
(NaCl), é CORRETO afirmar que:
Sobre a eletrólise de uma solução aquosa de cloreto de sódio
(NaCl), é CORRETO afirmar que:
A
no anodo ocorre a redução do cloreto e no catodo ocorre a
oxidação do íon de sódio.
B
no catodo ocorre a redução do cloreto e no anodo ocorre a
oxidação do hidrogênio presente na molécula de água.
C
no catodo ocorre a oxidação do oxigênio da água e no
anodo ocorre a redução do hidrogênio presente na
molécula de água.
D
no anodo ocorre a oxidação do cloreto e no catodo ocorre
a redução do hidrogênio presente na molécula de água.
 4NO
4NO  H < 0
H < 0