72713568-df
UFMT 2006 - Química - Sistemas Gasosos - Lei, Teoria Cinética, Equação e Mistura dos Gases. Princípio de Avogadro., Transformações Químicas
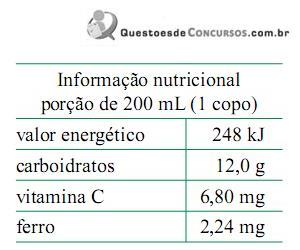
Observe a seqüência de transformações, mostradas no gráfico abaixo, sofrida por uma massa fixa de um gás ideal.

Considere essa massa de gás experimentando as seguintes transformações:
I - Estado inicial: A; Estado final: B.
II - Estado inicial: A; Estado final: C.
III - Estado inicial: A; Estado final: D.
IV - Estado inicial: B; Estado final: D.
V - Estado inicial: E; Estado final: A.
Assinale a transformação isobárica.
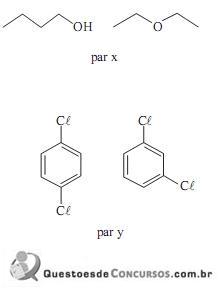
Observe a seqüência de transformações, mostradas no gráfico abaixo, sofrida por uma massa fixa de um gás ideal.

Considere essa massa de gás experimentando as seguintes transformações:
I - Estado inicial: A; Estado final: B.
II - Estado inicial: A; Estado final: C.
III - Estado inicial: A; Estado final: D.
IV - Estado inicial: B; Estado final: D.
V - Estado inicial: E; Estado final: A.
Assinale a transformação isobárica.
A
II
B
I
C
IV
D
V
E
III