Questõesde UEA sobre Química
Compressas de emergência quentes são usadas como primeiro socorro em contusões sofridas em práticas esportivas.
Essa compressa constitui-se de um saco de plástico contendo uma ampola de água e um produto químico seco, por
exemplo, o cloreto de cálcio (CaCℓ2
). Com uma leve pancada, a ampola se quebra e o cloreto de cálcio se dissolve,
conforme a reação representada pela equação:
CaCℓ2
(s) + H2O (ℓ) → CaCℓ2
(aq) ∆H = −82,7 kJ/mol
Nesse processo,
Na diluição de 100 mL de uma solução de hidróxido de
sódio (NaOH), de concentração 20 g/L, adicionou-se água
até completar o volume de 250 mL. O valor da concentração da solução após a diluição equivale a
Em um laboratório foi preparada uma solução de carbonato
de sódio (Na2
CO3
), que foi acondicionada num frasco apropriado, com as seguintes informações:

Considerando a massa molar desse composto igual a
106 g/mol, a concentração aproximada, em g/L e em mol/L,
de Na2CO3 nessa solução é, respectivamente,

O gás butano (C4H10) é um combustível não renovável derivado do petróleo, cuja combustão incompleta ocorre quando a quantidade de oxigênio é insuficiente para que ocorra a
combustão completa.
Considere a equação da reação de combustão incompleta do
gás butano:

A massa do gás monóxido de carbono (massa molar = 28 g/mol)
formada quando 522 kg de gás butano (massa molar = 58 g/mol)
sofrem combustão incompleta, numa reação com rendimento
total, é de

Considere a reação química que ocorre dentro de um recipiente fechado, à temperatura constante, e o gráfico com os
valores das concentrações de estado de equilíbrio químico
das espécies participantes.

Considerando os dados da reação e do gráfico, pode-se concluir que o valor da constante de equilíbrio químico (Kc
) para
essa reação é

Considerando o processo químico que ocorre no tanque de
floculação, pode-se concluir que as substâncias adicionadas
à água nesse recipiente foram:

A substância química gelatinosa formada no tanque de
floculação apresenta caráter _______ e valor de pH _______ 7 a 25 ºC. Ao combinar-se com um ácido, essa
substância forma _______ e , ocorrendo uma
reação de ________ .
Completam as lacunas do texto, respectivamente,

Admita uma solução aquosa de sulfato de ferro(II) que passou por um processo de eletrólise durante duas horas, empregando-se uma corrente elétrica com intensidade (i) de 5 A, e a semirreação a seguir:
Fe2 + (aq) + 2e- → Fe(s)
Considerando a Constante de Faraday = 96 500 C/mol, 1 hora = 3 600 s e massa molar do ferro (Fe) = 56 g/mol, a massa aproximada de ferro metálico que pode ser depositada no cátodo, nessas condições, é
Admita uma solução aquosa de sulfato de ferro(II) que passou por um processo de eletrólise durante duas horas, empregando-se uma corrente elétrica com intensidade (i) de 5 A, e a semirreação a seguir:
Fe2 + (aq) + 2e- → Fe(s)
Considerando a Constante de Faraday = 96 500 C/mol, 1 hora = 3 600 s e massa molar do ferro (Fe) = 56 g/mol, a massa aproximada de ferro metálico que pode ser depositada no cátodo, nessas condições, é
8,0 g.
11 g.
14 g.
21 g.
52 g.
Na diluição de 100 mL de uma solução de hidróxido de
sódio (NaOH), de concentração 20 g/L, adicionou-se água
até completar o volume de 250 mL. O valor da concentração da solução após a diluição equivale a
As essências artificiais de frutas e flores geralmente indicam
a presença de ésteres voláteis, que são obtidos ao se fazer
reagir um ácido carboxílico e um álcool, conforme a reação:  A nomenclatura IUPAC do éster formado que possui essência
de rum é
A nomenclatura IUPAC do éster formado que possui essência
de rum é

Ao se reagir 2-bromopropano com solução aquosa de hidróxido de potássio (KOH), obtém-se a equação:
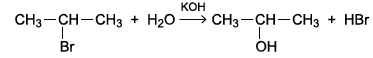
Essa equação representa uma reação orgânica de

Analise a cadeia carbônica do seguinte composto:

Essa cadeia carbônica é classificada como:
Analise a cadeia carbônica do seguinte composto:

Essa cadeia carbônica é classificada como:
As cetonas são utilizadas como solventes orgânicos e se caracterizam por apresentarem numa cadeia carbônica o grupo funcional carbonila, com seu carbono secundário. Considerando
a cetona de menor massa molar, seu isômero plano de função
pertence ao grupo funcional:
Compressas de emergência quentes são usadas como primeiro socorro em contusões sofridas em práticas esportivas.
Essa compressa constitui-se de um saco de plástico contendo uma ampola de água e um produto químico seco, por
exemplo, o cloreto de cálcio (CaCℓ2
). Com uma leve pancada, a ampola se quebra e o cloreto de cálcio se dissolve,
conforme a reação representada pela equação:
CaCℓ2
(s) + H2
O (ℓ) → CaCℓ2
(aq) ∆H = −82,7 kJ/mol
Nesse processo,
Compressas de emergência quentes são usadas como primeiro socorro em contusões sofridas em práticas esportivas. Essa compressa constitui-se de um saco de plástico contendo uma ampola de água e um produto químico seco, por exemplo, o cloreto de cálcio (CaCℓ2 ). Com uma leve pancada, a ampola se quebra e o cloreto de cálcio se dissolve, conforme a reação representada pela equação:
CaCℓ2 (s) + H2 O (ℓ) → CaCℓ2 (aq) ∆H = −82,7 kJ/mol
Nesse processo,
Em um laboratório foi preparada uma solução de carbonato
de sódio (Na2
CO3
), que foi acondicionada num frasco apropriado, com as seguintes informações:


Considerando a massa molar desse composto igual a
106 g/mol, a concentração aproximada, em g/L e em mol/L,
de Na2CO3 nessa solução é, respectivamente,


Considerando o processo químico que ocorre no tanque de
floculação, pode-se concluir que as substâncias adicionadas
à água nesse recipiente foram:
Leia o texto para responder à questão.
Na Estação de Tratamento de Água (ETA), diferentes substâncias químicas são adicionadas à água nos diversos tanques por onde ela passa. No tanque de floculação, por exemplo, a adição de certas substâncias químicas estimula a formação de um composto gelatinoso, o hidróxido de alumínio, que provoca a aglutinação das partículas de sujeira. Essas partículas aderem ao composto gelatinoso, formando flóculos sólidos de tamanho maior, que são facilmente sedimentáveis.

(www.sobiologia.com.br. Adaptado.)
Considere a reação química que ocorre dentro de um recipiente fechado, à temperatura constante, e o gráfico com os
valores das concentrações de estado de equilíbrio químico
das espécies participantes.
H2
(g) + Cℓ2
(g)  2HCℓ (g)
2HCℓ (g)

Considerando os dados da reação e do gráfico, pode-se concluir que o valor da constante de equilíbrio químico (Kc
) para
essa reação é
Considere a reação química que ocorre dentro de um recipiente fechado, à temperatura constante, e o gráfico com os valores das concentrações de estado de equilíbrio químico das espécies participantes.
H2
(g) + Cℓ2
(g) 2HCℓ (g)

Considerando os dados da reação e do gráfico, pode-se concluir que o valor da constante de equilíbrio químico (Kc
) para
essa reação é
O gás butano (C4
H10) é um combustível não renovável derivado do petróleo, cuja combustão incompleta ocorre quando a quantidade de oxigênio é insuficiente para que ocorra a
combustão completa.
Considere a equação da reação de combustão incompleta do
gás butano:
2C4
H10 (g) + 9O2
(g) 8CO (g) + 10H2
O (g)
A massa do gás monóxido de carbono (massa molar = 28 g/mol)
formada quando 522 kg de gás butano (massa molar = 58 g/mol)
sofrem combustão incompleta, numa reação com rendimento
total, é de
O gás butano (C4 H10) é um combustível não renovável derivado do petróleo, cuja combustão incompleta ocorre quando a quantidade de oxigênio é insuficiente para que ocorra a combustão completa.
Considere a equação da reação de combustão incompleta do gás butano:
2C4 H10 (g) + 9O2 (g) 8CO (g) + 10H2 O (g)
A massa do gás monóxido de carbono (massa molar = 28 g/mol) formada quando 522 kg de gás butano (massa molar = 58 g/mol) sofrem combustão incompleta, numa reação com rendimento total, é de
A substância química gelatinosa formada no tanque de
floculação apresenta caráter __________ e valor de pH ____________ 7 a 25 ºC. Ao combinar-se com um ácido, essa
substância forma ____________e _____________ , ocorrendo uma
reação de _____________.
Completam as lacunas do texto, respectivamente,
A substância química gelatinosa formada no tanque de floculação apresenta caráter __________ e valor de pH ____________ 7 a 25 ºC. Ao combinar-se com um ácido, essa substância forma ____________e _____________ , ocorrendo uma reação de _____________.
Completam as lacunas do texto, respectivamente,
Leia o texto para responder à questão.
Na Estação de Tratamento de Água (ETA), diferentes substâncias químicas são adicionadas à água nos diversos tanques por onde ela passa. No tanque de floculação, por exemplo, a adição de certas substâncias químicas estimula a formação de um composto gelatinoso, o hidróxido de alumínio, que provoca a aglutinação das partículas de sujeira. Essas partículas aderem ao composto gelatinoso, formando flóculos sólidos de tamanho maior, que são facilmente sedimentáveis.

(www.sobiologia.com.br. Adaptado.)