O álcool etílico combustível, mais popularmente conhecido como etanol, é uma fonte de energia limpa e renovável,
proveniente de várias matérias-primas como beterraba, milho e cana-de-açúcar, sendo esta última o insumo
agrícola mais utilizado na produção de etanol no Brasil.
Ao contrário dos combustíveis fósseis, o etanol é uma fonte de energia natural e limpa, pois sua composição não
contém poluentes que sejam prejudiciais à saúde e ao meio ambiente. Desde o momento em que brota no campo,
a cana-de-açúcar passa a absorver parte do gás carbônico utilizado na produção e no consumo do etanol.
A crescente fabricação brasileira de carros flex (movidos a gasolina e etanol), iniciada em 2003, foi o que permitiu o
avanço da utilização do etanol no Brasil. Atualmente, 97,7% dos carros produzidos no país podem ser abastecidos
com etanol ou gasolina, puros ou misturados em qualquer proporção.
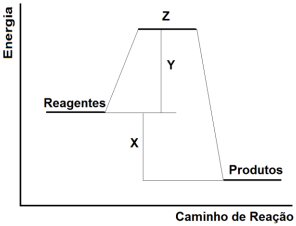
A equação química que representa o processo de combustão do etanol encontra-se mostrada a seguir.
C2H6O(l) + 3O2(g) → 2CO2(g) + 3H2O(l)
Sabendo-se que a entalpia de formação da H2O(l) é -286 kJ/mol; que a do CO2(g) é - 393,5 kJ/mol e que a do
C2H6O(l) é - 277,6 kJ/mol, verifica-se que a energia liberada na combustão de 1,0 mol de etanol é:
 2Ag2S(s) + 2H2O(l)
2Ag2S(s) + 2H2O(l)
 2Ag2S(s) + 2H2O(l)
2Ag2S(s) + 2H2O(l)

 em torno
de +12 kcal.mol-1
, a 25°C e 1 atm. A constante de equilíbrio desse processo está relacionada com a
em torno
de +12 kcal.mol-1
, a 25°C e 1 atm. A constante de equilíbrio desse processo está relacionada com a  para certa
temperatura T, através da relação
para certa
temperatura T, através da relação  Após essas informações, verifica-se que a reação
Após essas informações, verifica-se que a reação
 = -129,8 kcal.mol
= -129,8 kcal.mol =-161,9 kcal.mol
=-161,9 kcal.mol = -288,7 kcal.mol
= -288,7 kcal.mol
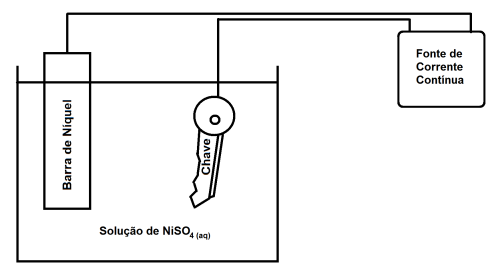
 Fe(s)
Fe(s)  Sn(s)
Sn(s) 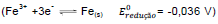 e estanho
e estanho 
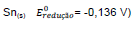 . Nesse caso, constata-se que
. Nesse caso, constata-se que



