O propanotriol, presente em alimentos
industrializados, é também usado como umectante,
solvente e amaciante. Utilizando-se a constante
ebulioscópica da água 0,512 cal/m, é correto afirmar
que o ponto de ebulição de 18,4 g de propanotriol
dissolvidos em 500 g de água é, aproximadamente,




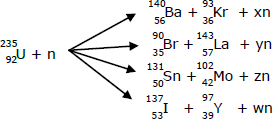
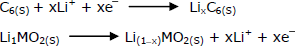
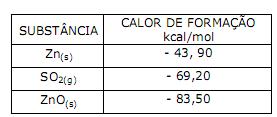

 A reação se torna mais agressiva por sofrer um natural deslocamento para a direita. Apenas com as informações disponíveis na equação acima, marque a alternativa que contempla a explicação para esse fato.
A reação se torna mais agressiva por sofrer um natural deslocamento para a direita. Apenas com as informações disponíveis na equação acima, marque a alternativa que contempla a explicação para esse fato.