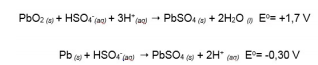A bateria automotiva de chumbo e solução ácida
é formada de células voltaicas em série, conforme as semi-reações, a seguir:
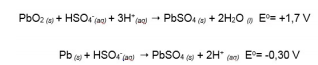
Analise as alternativas abaixo selecionadas com
as semi-reações (1) e (2).
I. Na Equação 1, é onde ocorre a reação de oxidação, e na Equação 2 a reação de redução.
II. A Equação 1 pode ser identificada como anodo e a Equação 2 o catodo.
III. No processo eletroquímico, estão envolvidos
2 mols de elétrons.IV. O chumbo é agente redutor e, também,
agente oxidante.
V. A célula voltaica gera 2 Volts.
Está incorreto o que se afirma em