Questõesde FATEC sobre Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess.
O éster acetato de etila é utilizado na indústria química como solvente e como flavorizante, para conferir sabor artificial de
maçã ou pera aos alimentos.
Este composto também pode ser preparado a partir de uma reação de esterificação:
CH3
–CH2
–OH (l) + CH3
–COOH (l) CH3 ⇌ COOCH2
–CH3 (l) + H2O (l)
Para calcularmos a variação de entalpia da reação, ∆H, podemos aplicar a lei de Hess às equações de combustão dos
compostos orgânicos presentes na reação de esterificação, apresentadas a seguir.
I. CH3–CH2
–OH (l) + 3 O2 (g) ⇾ 2 CO2 (g) + 3 H2O (l) ∆H = – 1 368 kJII. CH3COOH (l) + 2 O2 (g) ⇾ 2 CO2 (g) + 2 H2O (l) ∆H = – 875 kJIII. CH3COOCH2CH3 (l) + 5 O2 (g) ⇾ 4 CO2 (g) + 4 H2O (l) ∆H = – 2 231 kJ
Aplicando a lei mencionada, a variação de entalpia da reação de esterificação descrita será, em kJ, igual a
A entalpia de combustão do hidrogênio, H2(g),
considerado por muitos o “combustível do
futuro”, produzindo água no estado gasoso, é
∆H ≈ -3 x 102 kJ/mol.
Caso a combustão desse combustível seja
usada para gerar energia elétrica, a massa de
hidrogênio, que deve ser queimada para fornecer
os 200 kWh que são consumidos por mês em
determinada residência, será aproximadamente,
em quilogramas,
Dados:
1 kWh = 3,6 x 103 kJ
Considere que apenas 50% da
energia da combustão seja convertida em energia elétrica.
Fazer a mala para uma viagem poderá
ser tão simples como pegar algumas
latas de spray, que contenham uma
mistura de polímero coloidal, para
fazer suas próprias roupas “spray-on”.
Tanto faz se é uma camiseta ou um
traje noturno, o tecido “spray-on” é
uma novidade para produzir uma
variedade de tecidos leves. A fórmula
consiste em fibras curtas interligadas
com polímeros e um solvente que
produz o tecido em forma líquida.
Esse tecido provoca uma sensação
fria ao ser pulverizado no corpo,
mas adquire a temperatura corporal
em poucos segundos. O material é
pulverizado diretamente sobre a pele
nua de uma pessoa, onde seca quase
instantaneamente.

(http://tinyurl.com/qermcv6 Acesso em: 29.08.2014. Adaptado. Original colorido)
A sensação térmica provocada pelo tecido “spray-on”,
quando pulverizado sobre o corpo, ocorre porque o
solvente
Fazer a mala para uma viagem poderá ser tão simples como pegar algumas latas de spray, que contenham uma mistura de polímero coloidal, para fazer suas próprias roupas “spray-on”. Tanto faz se é uma camiseta ou um traje noturno, o tecido “spray-on” é uma novidade para produzir uma variedade de tecidos leves. A fórmula consiste em fibras curtas interligadas com polímeros e um solvente que produz o tecido em forma líquida. Esse tecido provoca uma sensação fria ao ser pulverizado no corpo, mas adquire a temperatura corporal em poucos segundos. O material é pulverizado diretamente sobre a pele nua de uma pessoa, onde seca quase instantaneamente.

(http://tinyurl.com/qermcv6 Acesso em: 29.08.2014. Adaptado. Original colorido)
A sensação térmica provocada pelo tecido “spray-on”,
quando pulverizado sobre o corpo, ocorre porque o
solvente
Considere uma vela composta de um hidrocarboneto
( fórmula molecular C22H46 ) cuja combustão completa
libera apenas gás carbônico e água.
Pode-se concluir corretamente que, na combustão
completa de 1 mol desse hidrocarboneto, as quantidades
de matéria, e CO2 e de H2O produzidas são, em mol,
respectivamente, iguais a
O benzeno sofre reação de combustão segundo a equação
balanceada
C6H6(ℓ) + 15/2 O2 (g) → 6 CO2(g) + 3 H2O (ℓ)
A entalpia de combustão do benzeno pode ser
determinada conhecendo-se os valores das entalpias de
formação do gás carbônico, assim como da água e do
benzeno líquidos.
A tabela apresenta os valores de entalpia de formação de
algumas substâncias nas condições padrão.
Substância Entalpia de formação
(kJ/mol)
C6H6(ℓ) + 50 CO2(g) – 394
H2O (ℓ) – 286
A entalpia de combustão completa do benzeno,
em kJ/mol, é
Leia o texto para responder a questão.
De onde vem o cheiro de carro novo?
De acordo com o gerente de uma montadora de veículos, o cheiro é composto por uma combinação de vários tipos de substâncias químicas usadas na fabricação do veículo, incluindo solventes, plásticos, colas, tecidos e borracha. Porém, muitas delas são altamente tóxicas, porque contêm Compostos Orgânicos Voláteis (COVs) em sua composição, como benzeno, tolueno e formol, que podem ser letais dependendo da quantidade. Eles acabam escapando e impregnando o ar, porque não requerem altas temperaturas para evaporarem.
<http://tinyurl.com/y8ucob6c> Acesso em: 13.11.2017. Adaptado.
Dadas as entalpias de formação dos compostos:
CO2(g) ΔHf = - 393 kJ/mol
H2O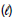 ΔHf = - 286 kJ/mol
ΔHf = - 286 kJ/mol
conclui-se, corretamente, que a entalpia de formação do combustível presente em I é, em kJ/mol,
Dadas as entalpias de formação dos compostos:
CO2(g) ΔHf = - 393 kJ/mol
H2O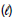 ΔHf = - 286 kJ/mol
ΔHf = - 286 kJ/mol
conclui-se, corretamente, que a entalpia de formação do combustível presente em I é, em kJ/mol,
 + 3O2(g) → 2CO2 (g) + 3H2O
+ 3O2(g) → 2CO2 (g) + 3H2O  ΔH = - 1366,8kJ
ΔH = - 1366,8kJ + 25/2 O2(g) → 8 CO2(g) + 9 H2O
+ 25/2 O2(g) → 8 CO2(g) + 9 H2O  ΔH = –5 461,0 kJ
ΔH = –5 461,0 kJUma indústria necessita conhecer a mecânica das reações
para poder otimizar sua produção.
O gráfico representa o mecanismo de uma reação hipotética:
A2
+ B2 → 2 AB

A análise do gráfico permite concluir corretamente que

Uma das áreas de aplicação dos conhecimentos de biotecnologia no mercado de trabalho é a produção de alimentos, bebidas e biocombustíveis que utilizam microorganismos em sua fabricação. Nesse contexto, um dos processos utilizados é a fermentação de carboidratos.
A equação química que representa a reação que ocorre na fermentação alcoólica da glicose é
C6H12O6(aq) → 2 C2H6O(aq) + 2 CO2(g) ΔrH = ?
Assinale a alternativa que apresenta o valor correto da entalpia padrão da reação (ΔrH) de fermentação da glicose, em kJ/mol.
Entalpias de formação em kJ/mol
Substância ΔfHC6H12O6(aq) – 1 277C2H6O (aq) – 278CO2(g) – 394
Considere a reação de formação da amônia N2 (g) + 3H2 (g) ⇌ 2NH3 (g) e o gráfico, que mostra a influência conjunta da pressão e da temperatura no seu rendimento.
A análise do gráfico permite concluir, corretamente, que:
A análise do gráfico permite concluir, corretamente, que:
