c60f005c-e0
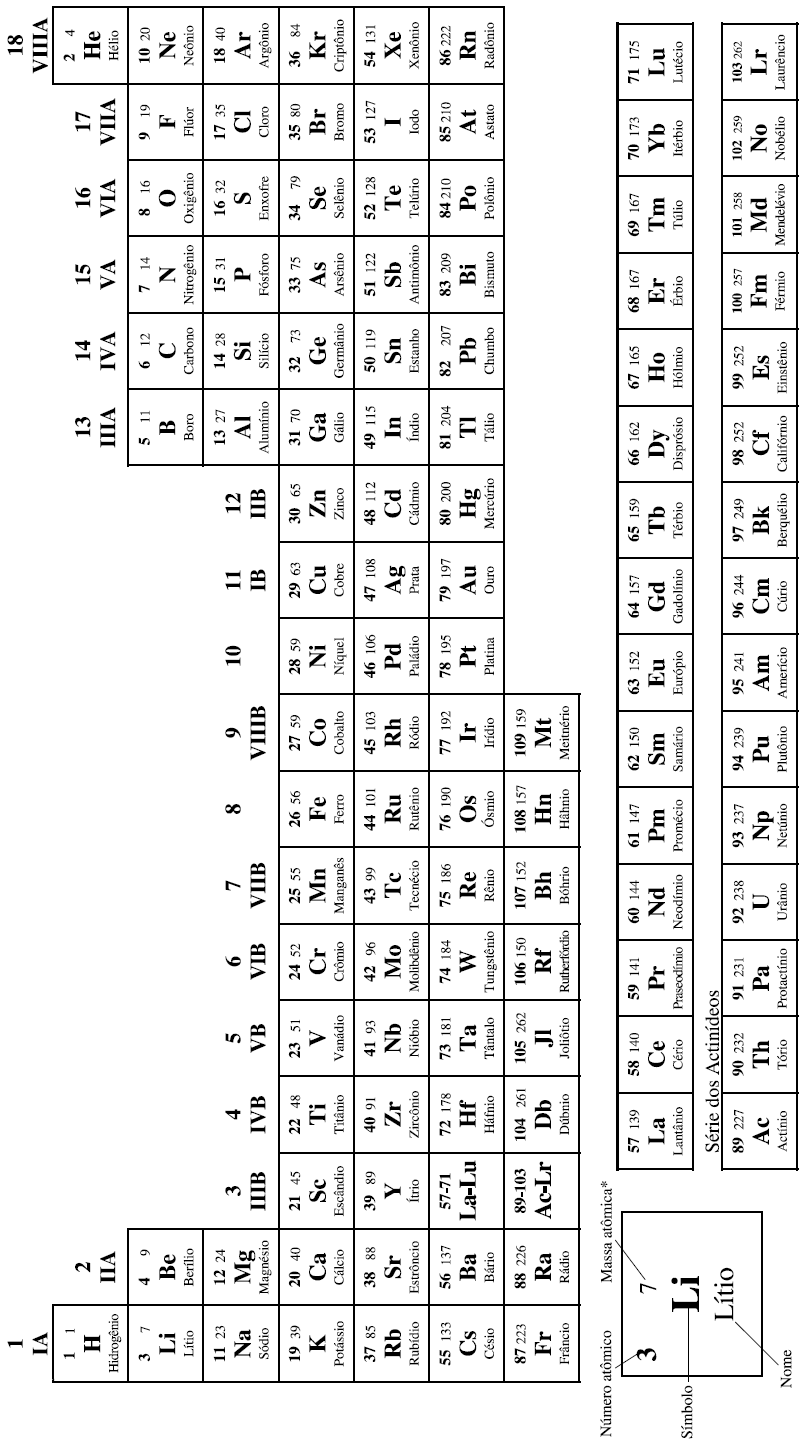
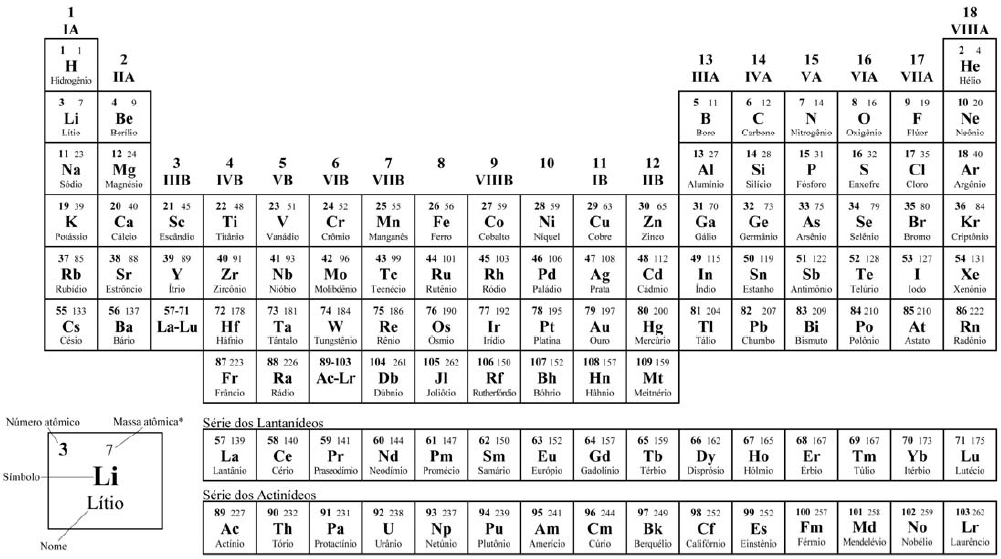
UEM 2011 - Química - Transformações Químicas e Energia, Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess.
A dissolução desse sal em água é um processo
exotérmico.
A dissolução desse sal em água é um processo
exotérmico.
O CaCO3 é um sal pouco solúvel em água. Sabe-se
que o valor da constante do produto de solubilidade
(Kps) do CaCO3, a 25 °C, é igual a 4,0 x 10-10.
Dado: massa molar do CaCO3 = 100 g/mol.
CaCO3(s)  Ca+2
(aq) + (CO3)-2(aq) ∆H >0
Ca+2
(aq) + (CO3)-2(aq) ∆H >0
Com relação a esse equilíbrio, assinale o que for
correto.
C
Certo
E
Errado