Questõessobre Teoria Atômica: Modelo atômico de Dalton, Thomson, Rutherford, Rutherford-Bohr
Baseado na proposta de Rutherford, Bohr
sugeriu que os elétrons, em algumas órbitas
bem definidas, chamadas estacionárias, não
emitem nem absorvem energia (denominado
modelo de Rutherford-Bohr).
Considerando o modelo de Rutherford-Bohr, ao
saltar de uma órbita para outra, o elétron emite
ou absorve uma quantidade de energia bem
definida, chamada quantum de energia.
Esse modelo surgiu de observações
experimentais realizadas por Rutherford,
utilizando partículas alfa que colidiam com uma
folha fina de ouro.
Esse modelo não é adequado porque o elétron
cairia no núcleo, devido à força centrípeta
dada pela atração entre o elétron e o núcleo.
Esse modelo foi substituído pelo modelo de
Thomson.
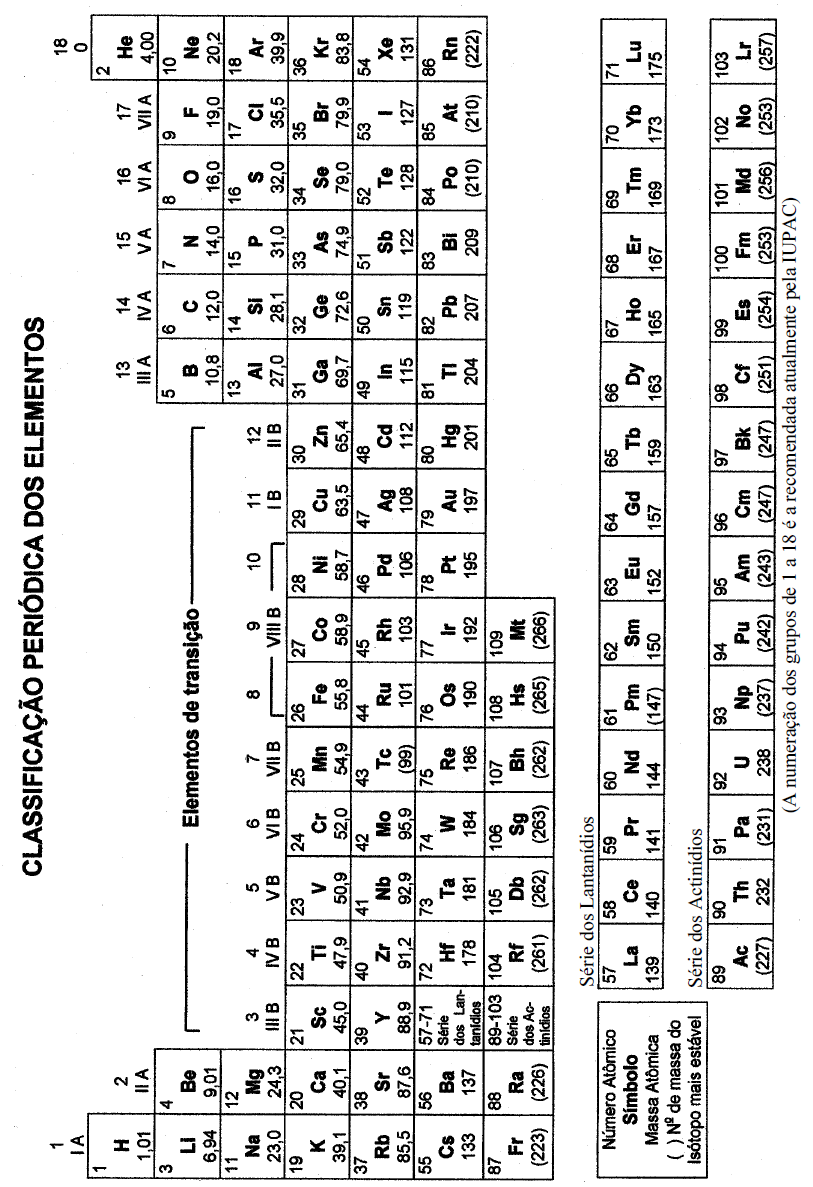
A configuração eletrônica é uma representação da distribuição
de elétrons entre os vários orbitais de um átomo.
Como no estado fundamental, os elétrons estão nas condições
de energia mais reduzida, pode-se utilizar o princípio de
exclusão de Pauli e da regra de Hund, para escrever as
distribuições dos elétrons em átomos e relacioná-las com a
localização dos elementos químicos nos grupos e períodos da
Tabela Periódica.
Considerando-se essas informações, e ao compará-las com
o elemento químico samário, é correto concluir:
O modelo proposto por Bohr introduziu um único número quântico para descrever o
comportamento do elétron no átomo. O modelo da mecânica quântica usa três números
quânticos.
Sobre os números quânticos propostos no modelo de Bohr e no modelo da mecânica
quântica, é CORRETO afirmar que
Nos átomos, o número quântico magnético está
relacionado com a quantização espacial e indica a
energia do elétron no orbital.
Nos átomos, o número quântico secundário está
relacionado à forma do orbital onde se encontra o
elétron.
Nos átomos, o número quântico principal está
relacionado aos níveis de energia dos elétrons.
O princípio de exclusão de Pauli afirma que, em um
mesmo átomo, não podem existir dois elétrons com o
mesmo conjunto de números quânticos.
A teoria quântica revolucionou a Física no início do
século 20, quando Planck e Einstein postularam que a
energia da luz é emitida ou absorvida em quantidades
discretas conhecidas como quanta. Em 1913, Bohr
incorporou esta ideia em seu modelo do átomo. Em
1924, Louis de Broglie propôs que todas as partículas
subatômicas, como os elétrons, exibem um grau de
comportamento ondulatório. Schrödinger, demonstrou
que o movimento de um elétron em um átomo poderia
ser melhor explicado como uma função de onda, e não
como uma partícula pontual.
Com relação a essas descrições, três afirmações
foram feitas:
1) Nos átomos ou moléculas, os elétrons podem
absorver ou emitir energia, passando de um
orbital para outro.
2) A teoria quântica foi fundamental para o
desenvolvimento do modelo atômico atual.
3) O modelo atômico de Bohr é o modelo atômico
mais atual.
Está(ão) correta(s) a(s) afirmativa(s):
Com relação a essas descrições, três afirmações foram feitas:
1) Nos átomos ou moléculas, os elétrons podem absorver ou emitir energia, passando de um orbital para outro.
2) A teoria quântica foi fundamental para o desenvolvimento do modelo atômico atual.
3) O modelo atômico de Bohr é o modelo atômico mais atual.
Está(ão) correta(s) a(s) afirmativa(s):
A regra de Hund, como o próprio nome indica,
foi formulada pela primeira vez, em 1927, pelo físico
alemão Friedrich Hund. Ele partiu diretamente da
estrutura nuclear, já conhecida e medida, das
moléculas e tentou calcular as orbitais moleculares
adequadas por via direta, resultando na regra de
Hund. Essa regra afirma que a energia de um orbital
incompleto é menor quando nela existe o maior
número possível de elétrons com spins paralelos.
Considerando a distribuição eletrônica do átomo de
enxofre em seu estado fundamental (Z = 16),
assinale a opção que apresenta a aplicação correta
da regra de Hund.
ELEMENTO NÚMERO MASSA
QUÍMICO ATÔMICO ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Cr 24 52,0
Cu 29 63,5
As 33 75,0
Br 35 80,0
Ag 47 108,0
Sn 50 119,0
Ir 77 192,0
Au 79 197,0
Hg 80 200,0
1s2 2s2 2p6 3s2 3px2 3py1 3pz1
A primitiva ideia da existência do átomo é
atribuída a Demócrito e Leucipo, mas a primeira
teoria atômica é atribuída a Epicuro (341-271 a.C.),
conforme registros na obra de Titus Lucretius Carus
(99-55 a.C.), no livro De Rerum Natura. Durante
muitos séculos a teoria atômica permaneceu latente
e só foi resgatada em pleno século XIX, com o modelo atômico conhecido como "bola de brilhar" atribuído a
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
QUÍMICO ATÔMICO
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Fe 26 56,0
Cu 29 63,5
Zn 30 65,4
Ag 47 108,0
Sn 50 119,0
Xe 54 131,0
W 74 184,0
Há cerca de dois mil e quinhentos anos, o
filósofo grego Demócrito disse que se dividirmos a
matéria em pedacinhos, cada vez menores,
chegaremos a grãozinhos indivisíveis, que são os
átomos (a = não e tomo = parte). Em 1897, o físico
inglês Joseph Thompson (1856-1940) descobriu que
os átomos eram divisíveis: lá dentro havia o elétron,
partícula com carga elétrica negativa. Em 1911, o
neozelandês Ernest Rutherford (1871-1937)
mostrou que os átomos tinham uma região central
compacta chamada núcleo e que lá dentro
encontravam-se os prótons, partículas com carga
positiva.
Atente à figura a seguir, que representa o núcleo e a
eletrosfera do átomo.

Com relação à figura acima, é correto afirmar que

ELEMENTO NÚMERO MASSA
QUÍMICO ATÔMICO ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Cr 24 52,0
Cu 29 63,5
As 33 75,0
Br 35 80,0
Ag 47 108,0
Sn 50 119,0
Ir 77 192,0
Au 79 197,0
Hg 80 200,0
A alquimia ‒ mistura de arte, ciência e magia
precursora da química ‒ elencou como objetivos a
busca do elixir da longa vida e da pedra filosofal que
permitiria a transformação de metais comuns em
ouro. Inobstante o insucesso de suas pesquisas
naquele campo restrito, a alquimia deixou um
grande legado para a ciência química. Assinale a
opção que corresponde a contribuições efetivas da
alquimia.
ELEMENTO NÚMERO MASSA
QUÍMICO ATÔMICO ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Cr 24 52,0
Cu 29 63,5
As 33 75,0
Br 35 80,0
Ag 47 108,0
Sn 50 119,0
Ir 77 192,0
Au 79 197,0
Hg 80 200,0
Atente para o seguinte enunciado: “[...] há no átomo uma quantidade fundamental que aumenta em passos regulares conforme passamos de um elemento ao seguinte. Essa quantidade só pode ser a carga do núcleo central positivo, de cuja existência já temos a prova definitiva”. Essa descoberta, que permitiu definir o número atômico criando uma nova lei de recorrência para a tabela periódica, é atribuída a

Os modelos atômicos fornecem condições para o entendimento em nível microscópico de vários processos
físico-químicos, levando a um elo com processos macroscópicos. Qual dos processos o modelo atômico de
Dalton seria capaz de explicar?
Quando uma pequena quantidade de cloreto de sódio é colocada na ponta de um fio de platina e levada à chama de um bico de Bunsen, a observação macroscópica que se faz é que a chama inicialmente azul adquire uma coloração laranja. Outros elementos metálicos ou seus sais produzem uma coloração característica ao serem submetidos à chama, como exemplo: potássio (violeta), cálcio (vermelho-tijolo), estrôncio (vermelho-carmim) e bário (verde). O procedimento descrito é conhecido como teste de chama, que é uma técnica utilizada para a identificação de certos átomos ou cátions presentes em substâncias ou misturas.
Sobre o assunto acima e com base na Teoria Atômica, é CORRETO afirmar que:
as cores observadas podem ser explicadas considerando-se o modelo atômico proposto por
Bohr.
Quando uma pequena quantidade de cloreto de sódio é colocada na ponta de um fio de platina e levada à chama de um bico de Bunsen, a observação macroscópica que se faz é que a chama inicialmente azul adquire uma coloração laranja. Outros elementos metálicos ou seus sais produzem uma coloração característica ao serem submetidos à chama, como exemplo: potássio (violeta), cálcio (vermelho-tijolo), estrôncio (vermelho-carmim) e bário (verde). O procedimento descrito é conhecido como teste de chama, que é uma técnica utilizada para a identificação de certos átomos ou cátions presentes em substâncias ou misturas.
Sobre o assunto acima e com base na Teoria Atômica, é CORRETO afirmar que:
as cores observadas podem ser explicadas considerando-se o modelo atômico proposto por
Bohr.